L’ADN d’un rétrovirus ayant intégré le génome des premiers animaux il y a plus de 500 millions d’années est impliqué dans une étape clé du développement embryonnaire précoce, selon une récente étude. Jusqu’ici considéré comme de l’ADN indésirable, ce matériel génétique régulerait notamment la transition des cellules de l’ovocyte fécondé vers un état pluripotent, quelques heures seulement après la fécondation.
Les infections virales font partie des principaux facteurs ayant contribué à l’évolution des premiers animaux sur Terre. Le matériel génétique de ces virus, dits « rétrovirus endogènes », a notamment intégré le génome des premiers organismes multicellulaires (par le biais d’une infection) et aurait même contribué à l’explosion cambrienne il y a plus de 500 millions d’années. Cet ADN primitif compose aujourd’hui 8 à 10 % du génome des mammifères.
Ces protéines virales étaient jusqu’à il y a peu considérées comme de l’ADN indésirable ou inutile, voire potentiellement nocif. « Intuitivement, on pensait qu’avoir des virus dans le génome ne pouvait pas être une bonne chose », explique dans un communiqué Sergio De la Rosa, du Centre national espagnol de recherche sur le cancer (Centro Nacional de Investigaciones Oncológicas, ou CNIO).
Cependant, de récentes recherches suggèrent que ce matériel génétique viral a des fonctions bien plus importantes que précédemment estimé, telles que la régulation de certains gènes essentiels à nos fonctions biologiques. Dans leur nouvelle étude, publiée dans la revue Science Advances, De la Rosa et son équipe démontrent que les rétrovirus endogènes jouent un rôle clé dans le développement embryonnaire précoce. Cela pourrait avoir d’importantes implications pour la médecine régénérative et le développement d’embryons artificiels (nécessaires à l’étude des troubles liés à la grossesse et à la fertilité).
Transition d’un état totipotent à pluripotent
Le début du développement embryonnaire se manifeste par la conversion de l’ovocyte fécondé en un zygote totipotent, composé de cellules pouvant se différencier en n’importe quelle cellule formant l’organisme entier. Au cours de cette transition s’effectue un remplacement étendu du transcriptome maternel par l’activation du génome zygotique, ainsi qu’une reprogrammation épigénétique bien orchestrée des deux noyaux parentaux.
Au cours de l’étape suivante s’effectue une différenciation cellulaire, faisant passer les deux premières cellules totipotentes à quatre cellules pluripotentes. Ces dernières peuvent se différencier en n’importe quelle lignée spécialisée formant les différents tissus, excepté le tissu placentaire. Cependant, les mécanismes régissant cette transition d’un état totipotent à pluripotent étaient jusqu’à présent en grande partie incompris. « Les mécanismes qui contrôlent la stabilité des facteurs de pluripotence indispensables aux décisions concernant le destin des cellules restent à élucider », ont écrit les chercheurs du CNIO dans leur document. Or, cette transition constitue une étape critique pour l’ensemble du développement embryonnaire.
De la Rosa et ses collègues ont peut-être enfin élucidé le mystère en montrant qu’une protéine rétrovirale endogène appelée MERVL-gag est précisément impliquée dans la transition des cellules embryonnaires vers la pluripotence. « Il s’agit d’un rôle totalement nouveau pour les rétrovirus endogènes », déclare le coauteur principal de l’étude, Nabil Djouder, du CNIO. « Nous avons découvert un nouveau mécanisme qui explique comment un rétrovirus endogène contrôle directement les facteurs de pluripotence », ajoute-t-il.
Une coévolution symbiotique de plusieurs centaines de millions d’années
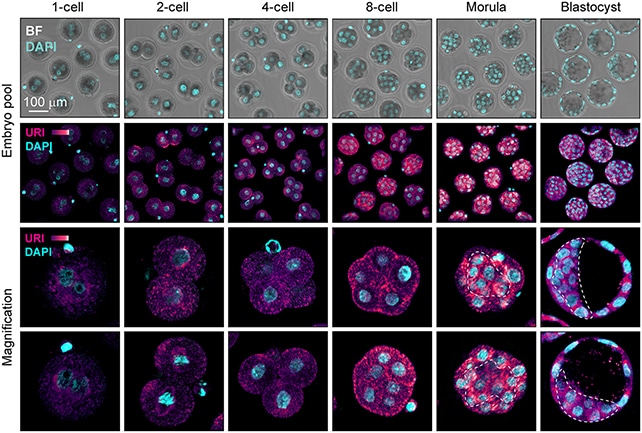
Des chercheurs ont précédemment révélé qu’un gène appelé URI est impliqué dans le développement embryonnaire. Il s’agit d’une protéine essentielle à la signalisation des nutriments et des facteurs de croissance, ainsi que dans l’homéostasie des organes adultes. Des expériences sur des souris ont montré que lorsqu’il était désactivé, le développement post-implantatoire des embryons était altéré.
Les observations des chercheurs du CNIO concordent avec ces résultats, montrant notamment que l’URI active la signalisation moléculaire nécessaire à l’acquisition de la pluripotence cellulaire. Si le gène est désactivé, les cellules embryonnaires restent à l’état de totipotence. En explorant plus avant le mécanisme par le biais d’expériences sur des embryons murins, ils ont découvert que MERVL-gag modulait l’activité de l’URI.
Au cours de la phase de totipotence, lorsqu’il n’y a encore que deux cellules dans l’ovocyte fécondé, l’expression de MERVL-gag est particulièrement élevée et inhibe l’activité d’URI. Cependant, ces niveaux s’inversent progressivement, de sorte que le niveau de MERVL-gag diminue et que l’URI peut entrer en action. La pluripotence apparaît ensuite lorsque l’ovocyte contient quatre cellules, quelques heures après la fécondation.
« La transition se fait en douceur. Lorsqu’il y a une forte expression de protéine virale, il y a moins de facteurs de pluripotence ; à mesure que l’expression de MERVL-gag diminue, l’URI stabilise ces facteurs », explique De la Rosa. Selon l’expert, cette interaction serait finement régulée selon un timing très précis, afin de laisser suffisamment de temps à l’embryon pour coordonner sa transition pluripotente en douceur. « Nos résultats révèlent la coévolution symbiotique des VRE avec leurs cellules hôtes pour assurer la progression fluide et rapide du développement précoce de l’embryon », concluent les chercheurs.