Lors d’un essai d’une nouvelle version de la thérapie cellulaire CAR-T, tous les patients ont enregistré une remarquable régression de leur glioblastome en seulement quelques jours. Conçu pour être plus polyvalent que le CAR-T standard, le traitement peut cibler une large population de cellules tumorales, améliorant ainsi considérablement son efficacité. Bien que les patients aient récidivé peu de temps après le traitement, les chercheurs estiment que la rapidité de la rémission initiale constitue déjà une avancée majeure en soi.
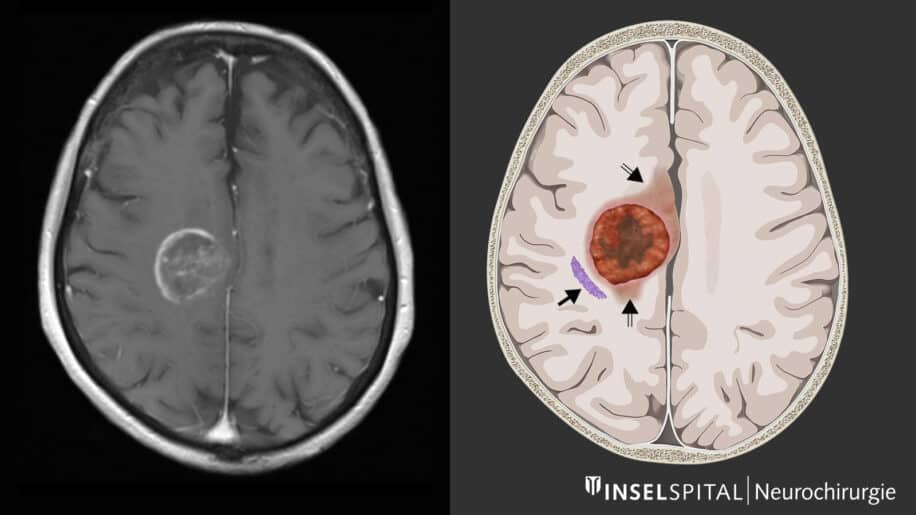
Le glioblastome (GBM) est la tumeur du système nerveux central la plus agressive, la plus invasive et la plus courante. Il émerge des cellules cérébrales de soutien et peut se développer au niveau de n’importe quelle partie du cerveau. On estime qu’il affecte environ 3 personnes sur 100 000 dans le monde, généralement âgées de 50 à 70 ans. En l’absence de traitement, le taux de survie à 5 ans ne dépasse généralement pas les 7 %.
Bien que le taux de survie puisse être amélioré avec la résection (de 80 %) de la tumeur, seule son élimination totale permet d’obtenir une amélioration optimale de la survie. Le traitement standard consiste en une combinaison de chirurgie, de radiothérapie et de chimiothérapie (protocole de Stupp), mais le taux de récidive reste très élevé.
D’un autre côté, la thérapie basée sur les Cellules du récepteur d’antigène chimérique (CAR-T) s’est montrée prometteuse pour traiter les tumeurs malignes, telles que les lymphoïdes réfractaires. Son efficacité découle de sa capacité de personnalisation pour chaque patient. En effet, la technique consiste à modifier génétiquement des cellules T provenant du patient lui-même de sorte à développer une reconnaissance antigénique des cellules tumorales, puis de les réinjecter au patient.
Il a été suggéré que la thérapie CAR-T peut aussi être utilisée pour traiter le GBM. Cependant, sa capacité à cibler les tumeurs solides est limitée, principalement en raison de l’hétérogénéité des cellules qui les composent. « La plateforme CAR-T a révolutionné notre façon de concevoir le traitement des patients atteints de cancers, mais les tumeurs solides comme le glioblastome restent difficiles à traiter, car toutes les cellules cancéreuses ne sont pas exactement identiques », explique dans un communiqué de presse Bryan D. Choi, neurochirurgien au Massachusetts General Hospital. De plus, les tumeurs solides possèdent un microenvironnement tumoral hautement immunosuppresseur.
Afin de surmonter ces défis, Choi et son équipe proposent une nouvelle stratégie combinant à la fois la thérapie CAR-T et les anticorps bispécifiques. Également appelés « anticorps engageant les lymphocytes T » (T-Cell Engaging Antibody Molecule, ou TEAM), il s’agit d’un type d’anticorps qui se lie à deux cibles plutôt qu’à une seule (comme les anticorps monoclonaux). « Notre approche combine deux formes de thérapies, nous permettant de traiter le glioblastome d’une manière plus large et potentiellement plus efficace », explique l’expert. Les résultats de l’étude sont disponibles dans la revue The New England Journal of Medicine.
Une réduction jusqu’à 60 % de la masse tumorale
Dans une précédente étude, Choi et ses collègues ont développé des cellules CAR-T ciblant une mutation cancéreuse courante appelée « variant 3 du récepteur du facteur de croissance épidermique » (EGFRv3). Bien que la stratégie ait induit une réponse positive chez les patients souffrant de GBM, aucune réponse n’a été observée au niveau des cellules tumorales récurrentes (responsables des récidives). Ces dernières expriment une mutation EGFR de type sauvage, qui n’est pas détectée au niveau des tissus sains, mais exprimée dans plus de 80 % des cas de GBM.
Afin de surmonter cet obstacle, les chercheurs ont développé des cellules CARv3-TEAM-E, qui ciblent à la fois l’EGFRv3 et induisent une sécrétion d’anticorps TEAM, qui peuvent reconnaître l’EGFR de type sauvage. L’approche a montré des résultats prometteurs chez des modèles précliniques de GBM. Les anticorps TEAM produits par les nouvelles versions de cellules CAR-T ont induit une réponse au niveau des sites présentant une forte hétérogénéité antigénique. Des essais in vitro ont également montré que ces molécules pouvaient provoquer l’activation des cellules T régulatrices, améliorant ainsi la réponse immunitaire contre les tumeurs.
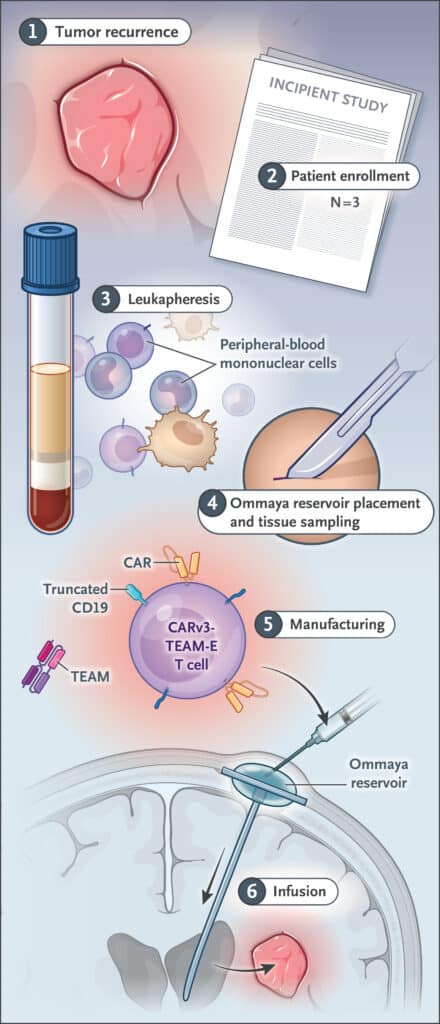


La nouvelle étude concerne un essai clinique de phase 1 non randomisé incluant 3 patients de 74, 72 et 57 ans. Tous les patients ont été initialement traités par radiothérapie standard et chimiothérapie à base de témozolomide. Ils ont ensuite été inclus à l’essai après une récidive. Le nouveau traitement CARv3-TEAM-E a été administré par le biais d’un réservoir d’Ommaya, un type de cathéter intraventriculaire offrant une voie directe vers le liquide céphalorachidien (LCR).
Chez le patient de 74 ans, le volume de la tumeur a rapidement diminué, mais de manière transitoire, après une seule perfusion de CARv3-TEAM-E. Son sang et son LCR ont montré une diminution significative du nombre de copies d’EGFRvIII et d’EGFR (de type sauvage). Le patient de 72 ans a montré une diminution de 18,5 % de la taille de sa tumeur, à seulement 2 jours après sa perfusion. Au 69e jour, la tumeur a diminué de 60,7 % et la réponse a été maintenue pendant plus de 6 mois. Quant au 3e patient (57 ans), la tumeur s’est presque complètement résorbée 5 jours après le traitement. Les effets indésirables relevés correspondent à ce qui est habituellement observé pour les thérapies CAR-T (fièvre et état mental altéré après la perfusion).
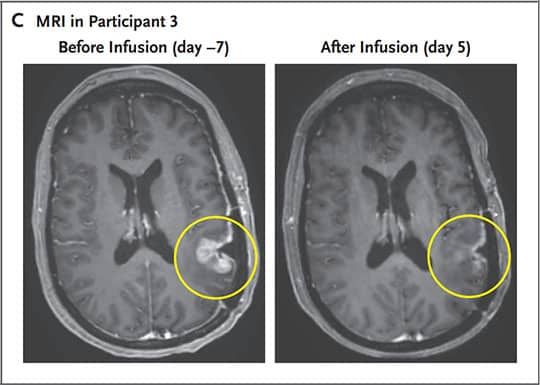


Cependant, bien que les réponses initiales au traitement soient remarquables, les patients ont malheureusement tous récidivé. Selon les experts, cela serait dû à la persistance limitée des cellules CARv3-TEAM-E au cours des semaines suivant le traitement — les patients n’ayant bénéficié que d’une seule perfusion. « Nous rapportons une réponse spectaculaire et rapide chez ces trois patients. Notre travail à ce jour montre que nous faisons des progrès, mais il reste encore beaucoup à faire », explique Elizabeth Gerstner, neuro-oncologue au département de neurologie du Massachusetts General Hospital et coauteure de la recherche. En prochaine étape, l’équipe prévoit d’effectuer des perfusions en série ainsi qu’une combinaison avec une chimiothérapie, dans l’espoir de prolonger la réponse au traitement.