Contrairement à ce que l’on pourrait intuitivement penser, la réponse n’est pas si simple. Peut-être avez-vous déjà remarqué qu’en plaçant de l’eau chaude dans le congélateur, celle-ci gelait plus rapidement que l’eau froide ? Cet étrange phénomène porte le nom d’effet Mpemba.
Découvert dans les années 60, même si l’on retrouve déjà des traces de ce phénomène physique dans l’Antiquité et à la Renaissance, l’effet Mpemba – du nom de l’étudiant cuisinier qui l’a observé en remarquant que la crème glacée se formait plus rapidement à partir de lait chaud que de lait froid – est l’effet par lequel, dans des conditions expérimentales de refroidissement identiques, l’eau chaude atteint son point de congélation plus rapidement que l’eau froide. Depuis sa (re)découverte, plusieurs scientifiques se sont attachés à préciser les conditions experimentales de l’apparition de l’effet Mpemba ainsi que son mécanisme.
I. Le paradoxe de l’effet Mpemba
L’effet Mpemba nous dit que dans des conditions de refroidissement similaires, pour un volume initial et un environnement identiques, l’eau chaude gèle plus vite que l’eau froide. Or, si l’on se réfère aux lois de la thermodynamique et que l’on dessine un cycle thermique basique, l’eau froide, plus proche de la température de congélation que l’eau chaude, devrait geler plus rapidement. Cependant, dans certaines conditions, ce n’est pas le cas.
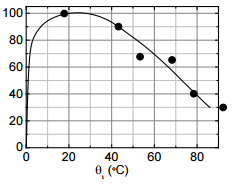
Un exemple : dans sa publication « O:H-O Bond Anomalous Relaxation Resolving Mpemba Paradox » (1), X. Zhang Yongli Huang montre qu’un volume d’eau à la température de 25°C gèle en 50 minutes alors qu’un volume d’eau à 35°C gèle en 40 minutes.
II. Les conditions d’apparition de l’effet Mpemba
L’effet Mpemba n’apparaît pas dans toutes les situations. Une équipe de chercheurs chinois et singapouriens (X. Zhang Yongli Huang, Z. Ma et C. Q Sun) (1), dans une étude publiée en 2013, ont relevé les conditions expérimentales suivantes :
- Aucune perturbation dans les volumes d’eaux froide et chaude
- Air réfrigéré (contrôle de la température et de la convection)
- Possibilité d’échanges thermodynamiques eau/air
Ces conditions sont donc relativement faciles à réunir pour observer l’effet Mpemba. À noter que tout changement, même infime, dans ces conditions peut neutraliser l’effet Mpemba.
III. Les causes de l’effet Mpemba
Jusqu’à aujourd’hui, plusieurs hypothèses sont avancées pour expliquer l’effet Mpemba, bien qu’aucune n’ait pour le moment reçu un consensus universel. On en dénombre généralement quatre :
A) La présence de gaz dissous
La thermodynamique nous apprend que la présence de gaz dans un liquide modifie le point de congélation de celui-ci. Dans le cas de l’eau, celle-ci contient une proportion de gaz tels que l’oxygène (O2) et le dioxyde de carbone (CO2) en quantités variables. Ces gaz influent sur le point de congélation de l’eau en l’abaissant, c’est-à-dire que plus il y a de gaz présents dans l’eau, plus celle-ci doit atteindre une température basse pour geler. Il se trouve que l’eau froide contient une plus grande fraction de gaz dissous que l’eau chaude dont les gaz ont pu s’évaporer (2). L’eau froide mettra donc plus de temps à geler que l’eau chaude dont le point de congélation est plus rapidement accessible.
B) L’évaporation
Là encore, la thermodynamique est inflexible : un volume d’eau chaude échange plus avec le milieu extérieur qu’un volume d’eau froide. Le coupable ? Le phénomène d’évaporation, c’est-à-dire la vaporisation progressive de l’eau dans le milieu extérieur. L’évaporation entraîne dès lors une diminution concomitante de la quantité d’eau chaude (plus précisément de sa masse), le volume d’eau chaude finit ainsi par être inférieur au volume d’eau froide et gèle alors plus rapidement. Cependant, une étude menée par B. Wojciechowski de l’université de Berlin en 1988, remet en cause cette hypothèse. En effet, l’étude montre que dans un milieu expérimental privé d’une interface eau/air (c’est-à-dire que l’eau est coupée du milieu extérieur), l’effet Mpemba peut quand même être observé.
C) La convection
La convection est définie comme la présence de mouvements au sein d’un fluide permettant le transport interne de propriétés thermiques intrinsèques. En d’autres mots, les mouvements qui animent un fluide créent des gradients de température qui se déplacent dans ce fluide. Il se trouve que l’eau chaude est le siège d’un phénomène de convection verticale d’ensemble plus important que pour l’eau froide, établissant un gradient de surface (différentiel de température entre la surface et le fond du récipient) très propice aux échanges thermiques avec l’extérieur et occasionnant un refroidissement plus rapide.
D) La surfusion
La surfusion est un état particulier de la matière puisqu’il s’agit d’un état métastable. La propriété physico-chimique d’un état métastable est son instabilité : une infime variation des conditions du milieu peut le faire basculer dans un état stable (solide, liquide, gazeux). Plus précisément, la surfusion est l’état d’un système physique qui demeure à l’état liquide alors que sa température est inférieure à son point de congélation. Ainsi, dans certaines conditions, l’eau reste à l’état liquide sous la température de 0°C. En raison d’un mouvement global de convection dans l’eau chaude, le gradient thermique ne favorise pas l’existence d’état métastable, l’eau chaude se retrouve donc moins sujette à la surfusion que l’eau froide et gèle ainsi plus vite.

