La maladie d’Alzheimer est une maladie neurodégénérative qui touche aujourd’hui plusieurs dizaines de millions de personnes dans le monde. Elle se caractérise par deux lésions : des dépôts amyloïdes et des enchevêtrements de protéine tau. Plusieurs traitements ont été développés durant les dernières années, ciblant l’une ou l’autre de ces lésions dans le but de retarder la progression de la maladie. Mais récemment, des chercheurs ont identifié un mécanisme crucial de la maladie : le processus par lequel la bêta-amyloïde entraîne les enchevêtrements de tau. Une découverte qui pourrait aboutir sur des traitements bien plus efficaces que les thérapies actuelles.
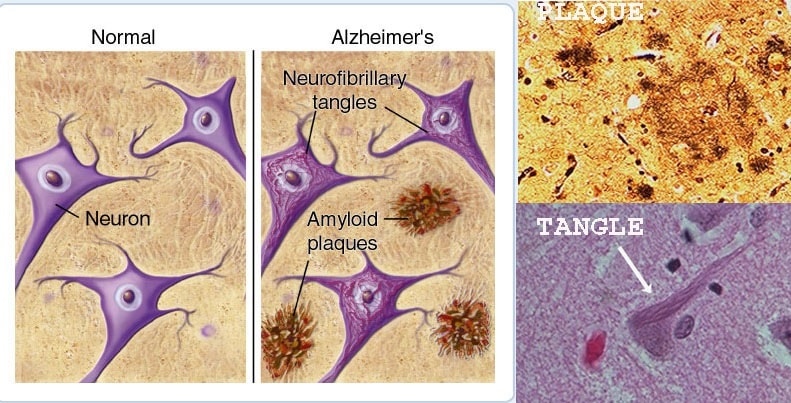
La maladie d’Alzheimer se caractérise depuis longtemps par l’accumulation de deux protéines distinctes dans le cerveau : d’abord la bêta-amyloïde, qui s’accumule en plaques, puis la tau, qui forme des enchevêtrements toxiques qui entraînent la mort cellulaire. Mais la façon dont la bêta-amyloïde conduit à la toxicité de la protéine tau n’a jamais été précisément connue. Maintenant, une nouvelle étude menée à l’Université de l’Alabama, à Birmingham, semble décrire ce mécanisme manquant.
Publiée dans la revue Science Translational Medicine, l’étude détaille une cascade d’événements. L’accumulation de bêta-amyloïde active un récepteur qui répond à un signal chimique du cerveau appelé noradrénaline, communément connu pour mobiliser le cerveau et le corps pour l’action. L’activation de ce récepteur à la fois par la bêta-amyloïde et la noradrénaline stimule l’activité d’une enzyme qui active la protéine tau et augmente la vulnérabilité des cellules cérébrales.
Le rôle de la noradrénaline dans la virulence de la maladie d’Alzheimer
Essentiellement, la bêta-amyloïde détourne la voie de la noradrénaline pour déclencher une accumulation toxique de tau, explique Qin Wang, chercheuse en neuropharmacologie au département de biologie cellulaire, développementale et intégrative de l’Université d’Alabama à Birmingham. « Nous montrons vraiment que cette noradrénaline est une pièce manquante de tout le casse-tête de la maladie d’Alzheimer ».
Cette cascade explique pourquoi tant de traitements antérieurs contre la maladie d’Alzheimer ont échoué. La plupart des médicaments développés au cours des dernières décennies ont visé l’élimination des bêta-amyloïdes. Mais la nouvelle recherche suggère que la noradrénaline amplifie les dommages causés par cette protéine. La bêta-amyloïde elle-même peut tuer les neurones, mais uniquement à des doses très élevées.
Ajoutez de la noradrénaline et il ne faut que 1 à 2% de bêta-amyloïde pour éliminer les cellules du cerveau dans une boîte de laboratoire. Donc, avec des traitements qui ciblaient la bêta-amyloïde mais laissaient la voie de la noradrénaline intacte, il restait suffisamment de bêta-amyloïde pour faire des dégâts importants. Mais si la voie de la noradrénaline est vraiment cruciale pour le développement de la maladie d’Alzheimer, elle suggère de nouvelles façons de traiter la maladie.
Vers le développement d’un médicament ciblant la voie de la noradrénaline
Un médicament qui a été développé pour traiter la dépression, mais trop inefficace pour être approuvé, semble agir sur cette même voie. Le médicament, l’idazoxan, qui a également été étudié dans la schizophrénie, a déjà subi les premiers tests cliniques et s’est révélé sûr. Wang cherche maintenant à promouvoir de plus grands essais cliniques sur l’idazoxan pour voir s’il peut être utilisé pour traiter efficacement la maladie d’Alzheimer à un stade précoce.
Elle espère qu’à terme, un médicament qui agira sur cette voie liée à la maladie d’Alzheimer de manière plus ciblée pourra être développé, afin de minimiser les effets secondaires et maximiser l’efficacité. Stephen Salloway, professeur de psychiatrie et de neurologie à la Warren Alpert Medical School de l’Université Brown, dit qu’il ne pense pas qu’Alzheimer cédera si facilement à un nouveau médicament ciblant la voie de la noradrénaline.
« Je doute qu’il y ait quelque chose de simple qui en ressortira. Je serais choqué si cela fonctionne ». Un tel médicament pourrait cependant faire partie d’un « ensemble thérapeutique » de traitements qui pourraient éventuellement faire avancer la maladie d’Alzheimer, dit-il. « Le but est de prendre pied sur le plan biologique, puis de le développer. Plus nous avons d’objectifs, plus l’impact est important ».
La liaison de la bêta-amyloïde à la noradrénaline serait responsable de la toxicité de la protéine tau
Wang étudie depuis longtemps la noradrénaline en raison de son rôle dans la pensée et les comportements complexes. Elle est tombée sur le lien avec Alzheimer dans le cadre de cette recherche. Dans deux souches de souris et dans des tissus humains dans leur nouvelle étude, elle et ses collègues ont montré que de petits morceaux de bêta-amyloïde se lient à un récepteur de la noradrénaline, activant l’enzyme GSK3-bêta et provoquant la toxicité du tau.
Sur le même sujet : Maladie d’Alzheimer : un mécanisme alternatif pourrait expliquer son apparition
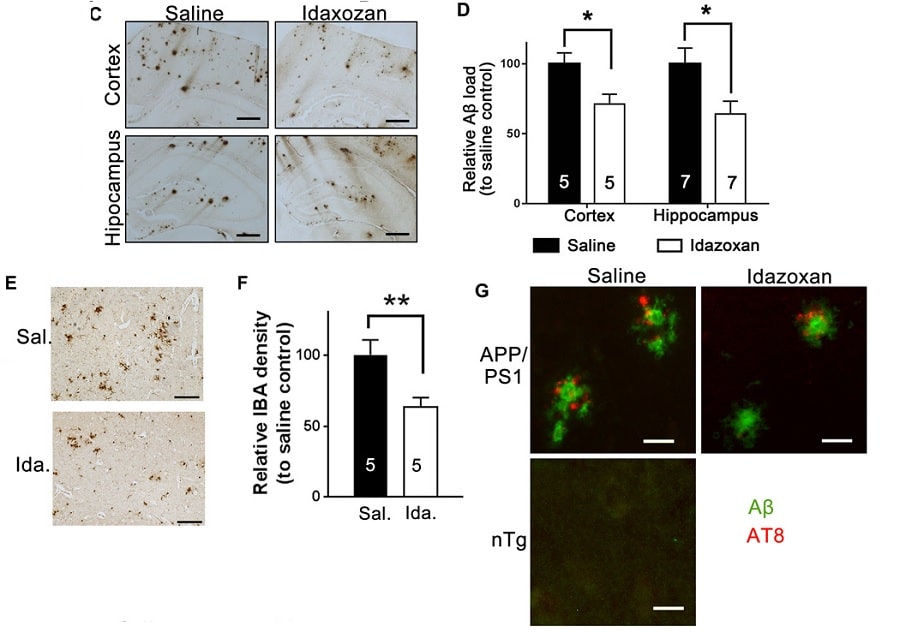
Ils ont confirmé cette relation en bloquant le récepteur avec l’idazoxan dans deux souches de souris d’âge moyen pendant huit semaines. Cela a désactivé l’enzyme et empêché tau de devenir toxique. Pendant des années, les chercheurs s’étaient demandés comment les bêta-amyloïdes et les tau étaient liés, explique Rudolph Tanzi, un expert en génétique moléculaire de la maladie d’Alzheimer au Massachusetts General Hospital.
Les scientifiques ont essentiellement supposé que la bêta-amyloïde avait provoqué des enchevêtrements de tau à travers une chaîne d’événements compliquée.. Puis, dans un article publié en 2014 dans Nature, Tanzi et ses collègues ont utilisé des cellules cérébrales humaines cultivées pour révéler un problème avec la théorie : les souris — la principale source d’informations de recherche sur la maladie d’Alzheimer — n’ont pas la bonne forme de tau qui s’enchevêtre chez les humains.
Bloquer l’enzyme GSk3-bêta pour neutraliser l’inflammation
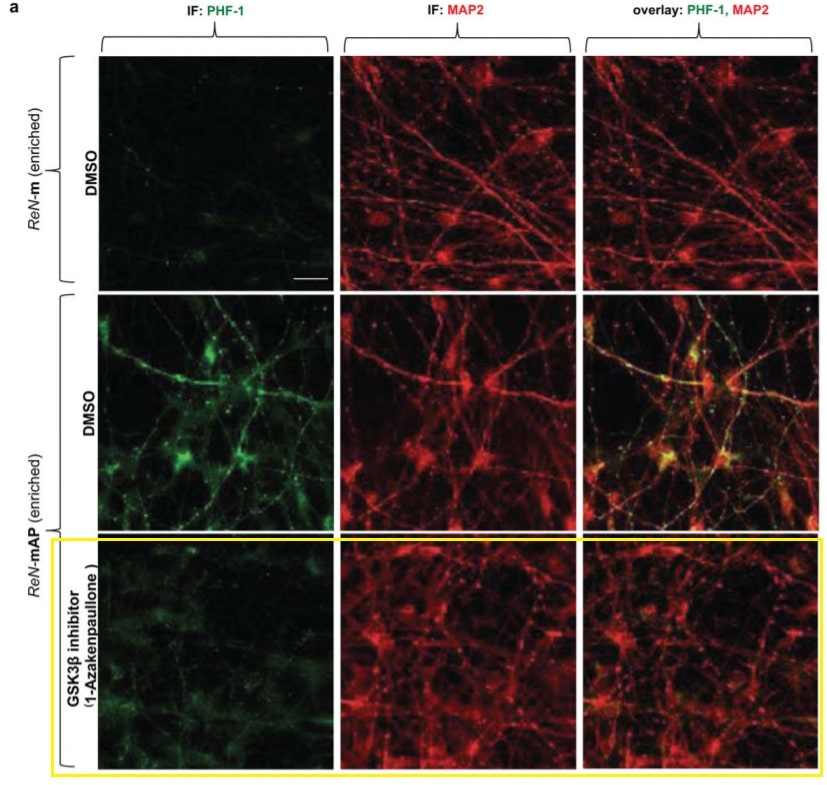
Au lieu de cela, les chercheurs ont montré que dans les cellules humaines, la bêta-amyloïde entraînait directement des enchevêtrements de tau. Tanzi et ses collègues ont bloqué une variété d’enzymes différentes appelées kinases pour essayer d’arrêter le processus. Ils en ont trouvé deux, qui bloquaient tous deux l’enzyme GSK3-bêta — la même que Wang et ses collègues ont identifiée dans leur recherche.


Tanzi croit que l’inflammation est un acteur clé dans la maladie d’Alzheimer, déclenchant la cascade qui mène à la maladie. Il a précédemment décrit la bêta-amyloïde comme l’allumette et les enchevêtrements de tau comme les broussailles qui prennent feu. Tanzi dit qu’il possède des données non publiées sur des dizaines de médicaments qui empêchent la bêta-amyloïde de déclencher des enchevêtrements, dont beaucoup soutiennent ce que Wang et ses collègues ont trouvé dans leur nouveau document.