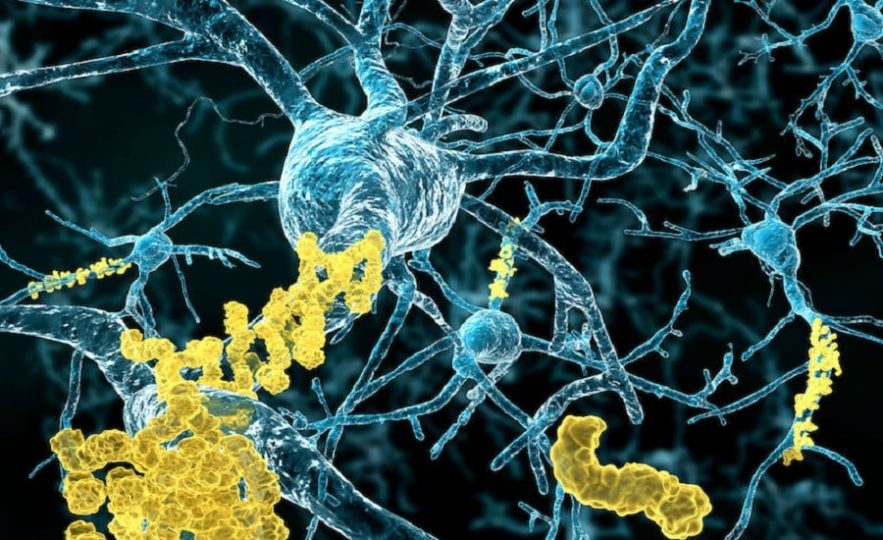
Décrite pour la première fois par le médecin allemand Alois Alzheimer en 1906, la maladie d’Alzheimer est une maladie neurodégénérative qui touche environ 50 millions de personnes dans le monde. Elle est caractérisée par l’existence de dépôts amyloïdes et de dégénérescences neurofibrillaires dans le cerveau, les traitements et recherches actuels ne se focalisent donc que sur ces deux facteurs. Cependant, des chercheurs américains ont identifié un autre mécanisme biochimique qui jouerait un rôle crucial dans l’apparition des différents symptômes de la maladie.
Les plaques et dégénérescences neurofibrillaires ont jusqu’ici attiré l’attention dans cette maladie progressive, qui touche actuellement plus de 2 millions de personnes rien qu’en France. Les plaques, dépôts d’un fragment de protéine appelé bêta-amyloïde, ressemblent à des amas protéiques situés dans les espaces entre les neurones. Les dégénérescences neurofibrillaires, fibres torsadées de tau, une autre protéine, ressemblent à des faisceaux de fibres qui s’accumulent à l’intérieur des cellules.
« La théorie dominante basée sur l’accumulation de bêta-amyloïde existe depuis des décennies et des dizaines d’essais cliniques fondés sur cette théorie ont été tentés, mais ils ont tous échoué » déclare Ryan R. Julian, professeur de chimie et auteur de l’étude. « En plus des plaques, on observe un stockage lysosomal dans le cerveau des personnes atteintes de la maladie d’Alzheimer. Les neurones sont sensibles aux problèmes lysosomaux, en particulier la surcharge lysosomale, dont nous rapportons qu’elle est une cause probable de la maladie d’Alzheimer ».
Une corrélation possible entre maladie d’Alzheimer et trouble lysosomal
Un organite situé dans les cellules, le lysosome, sert de décharge à ces dernières. Les anciennes protéines et lipides sont envoyés au lysosome pour être décomposés en leurs éléments constitutifs, qui sont ensuite renvoyés dans la cellule pour y être intégrés dans de nouvelles protéines et lipides. Pour maintenir la fonctionnalité cellulaire, la synthèse des protéines est équilibrée par la dégradation des protéines.
Le lysosome a cependant un point faible : si ce qui entre ne se décompose pas en petits morceaux, ces derniers ne peuvent pas non plus quitter le lysosome. La cellule décide alors que le lysosome ne fonctionne pas et le « stocke », signifiant qu’elle met le lysosome de côté et procède à la création d’un nouveau. Si le nouveau lysosome échoue également, le processus est répété, ce qui entraîne une surcharge cellulaire de lysosomes.
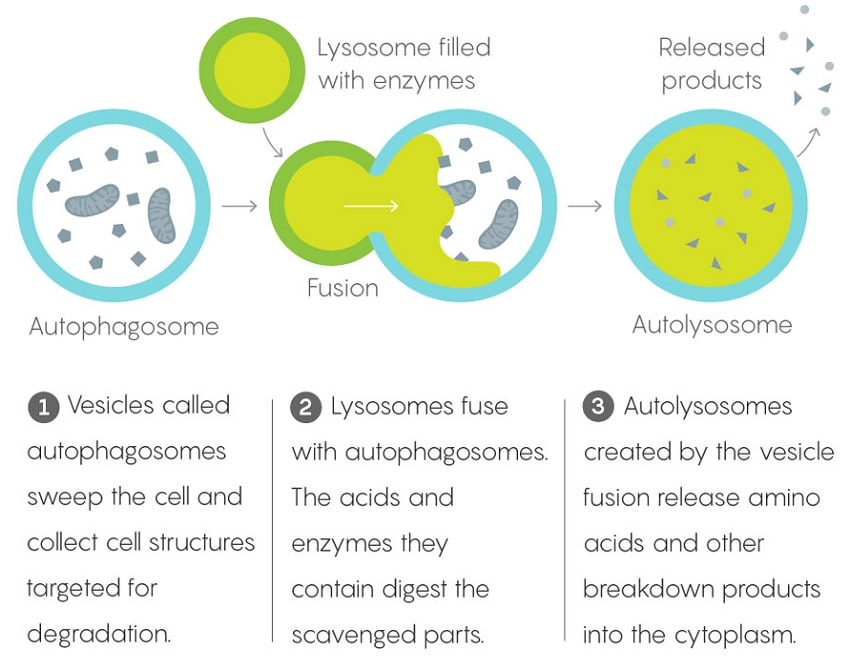
« Le cerveau des personnes atteintes du trouble de stockage lysosomal, une autre maladie bien étudiée, et celui des personnes atteintes de la maladie d’Alzheimer, sont similaires en matière de stockage lysosomal. Mais les symptômes du trouble de stockage lysosomal apparaissent au bout de quelques semaines après la naissance et sont souvent fatals au bout de quelques années. La maladie d’Alzheimer survient beaucoup plus tard dans la vie. Les délais sont donc très différents » explique Julian.
L’équipe de chercheurs du département de chimie et de la division des sciences biomédicales de l’UC Riverside affirme que les protéines à vie longue peuvent subir des modifications spontanées pouvant les rendre non digestibles par les lysosomes. « Les protéines à vie longue deviennent plus problématiques en vieillissant et pourraient expliquer le stockage lysosomal observé dans la maladie d’Alzheimer, une maladie liée à l’âge. Si nous avons raison, cela ouvrirait de nouvelles voies pour le traitement et la prévention de cette maladie » indique Julian.
Sur le même sujet : Maladie d’Alzheimer : des plaques amyloïdes éliminées chez des souris grâce à la lumière et au son
Des modifications biochimiques au sein des acides aminés
Les changements, décrits dans la revue ACS Central Science, se produisent dans la structure fondamentale des acides aminés qui composent les protéines. Cela équivaut à inverser l’orientation des acides aminés, les acides aminés acquérant spontanément les images miroir de leurs structures d’origine. « Les enzymes qui décomposent normalement les protéines ne peuvent alors pas le faire, car elles ne peuvent pas se fixer à la protéine ».
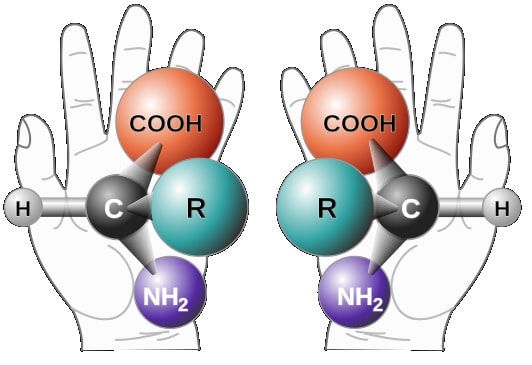
« C’est comme essayer d’adapter un gant de gaucher à votre main droite. Nous montrons dans notre article que cette modification structurelle peut se produire dans les protéines bêta-amyloïde et tau, importantes pour la maladie d’Alzheimer. Ces protéines subissent cette chimie presque invisible, ce qui peut expliquer pourquoi les chercheurs n’y ont pas prêté attention ».
« On sait depuis longtemps que ces modifications se produisent dans les protéines à vie longue, mais personne n’a jamais cherché à savoir si ces modifications pourraient empêcher les lysosomes de pouvoir décomposer les protéines. Une façon d’éviter cela serait de recycler les protéines afin qu’elles ne restent pas assez longtemps pour subir ces modifications chimiques. À l’heure actuelle, aucun médicament n’est disponible pour stimuler ce recyclage — un processus appelé autophagie — pour le traitement de la maladie d’Alzheimer » conclut Julian.