Le corps humain est une machine fantastique, qui continue de nous surprendre par ses capacités. La plupart de nos organes se renouvellent en permanence, éliminant les cellules mortes pour les remplacer par des nouvelles. Même notre cœur est capable d’autoréparation après un infarctus ! Des chercheurs américains se sont penchés sur cette prouesse de l’organisme et ont découvert quels mécanismes biologiques sont impliqués dans la restauration du muscle cardiaque.
L’infarctus du myocarde, ou « crise cardiaque », survient suite à l’obstruction d’une artère coronaire ; il entraîne une lésion d’une partie plus ou moins importante du muscle cardiaque. Bien que stabilisée et « cicatrisée » par des processus innés, cette lésion fragilise le cœur pour toujours. Par conséquent, l’infarctus est la cause la plus fréquente de l’insuffisance cardiaque, qui désigne l’incapacité du cœur à propulser normalement le sang dans l’organisme. Des traitements médicamenteux (bêtabloquants, inhibiteurs de l’enzyme de conversion de l’angiotensine) permettent de réduire les risques, mais ceux-ci restent tout de même élevés.
Des chercheurs ont donc tenté de mieux comprendre les mécanismes sous-jacents à la réparation naturelle du cœur, afin de trouver de meilleures approches thérapeutiques permettant de préserver la fonction cardiaque. Ils ont découvert que la réponse immunitaire et le système lymphatique sont au cœur de la réparation cardiaque : des cellules immunitaires de type macrophages se dirigent vers le cœur pour éliminer les tissus endommagés par l’infarctus, tout en stimulant la formation de nouveaux vaisseaux lymphatiques.
Des « bons » et des « mauvais » macrophages
Plus précisément, l’élimination des cellules lésées et mourantes par les macrophages — un processus appelé efférocytose — induit par la même occasion le facteur de croissance endothéliale vasculaire C (noté VEGFC) — une protéine dont le rôle est de déclencher la formation de nouveaux vaisseaux sanguins nécessaires à la croissance des tissus et au développement des organes. Le VEGFC entraîne ainsi la formation de nouveaux vaisseaux lymphatiques (ce que l’on appelle la lymphangiogenèse), favorisant la guérison.
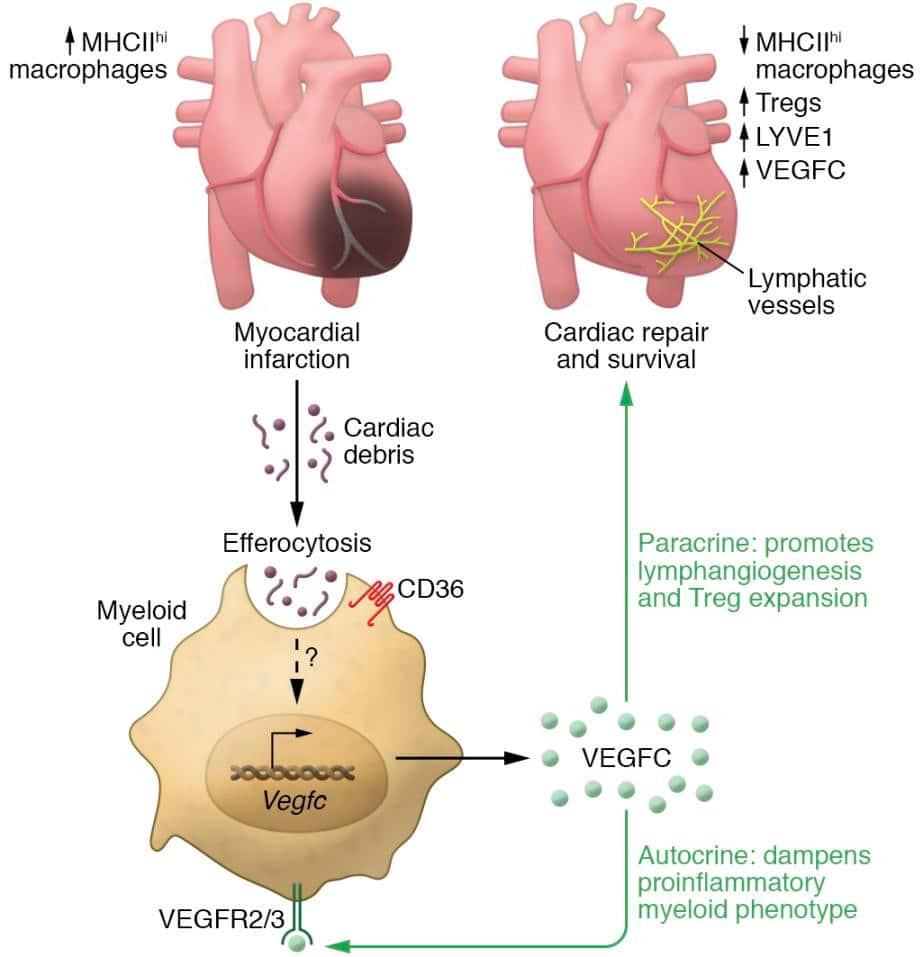
Malgré cet incroyable mécanisme d’autoréparation, les personnes ayant subi un infarctus demeurent à haut risque d’insuffisance cardiaque. Ceci est dû au fait que les macrophages qui parviennent au niveau de la lésion cardiaque à traiter ne sont pas tous identiques : alors que certains d’entre eux (les macrophages CD11b +) favorisent la guérison comme décrit ci-dessus, d’autres sont à l’inverse pro-inflammatoires et n’induisent pas de VEGFC.
Les chercheurs ont examiné le processus d’efférocytose d’un peu plus près en laboratoire, sur des cellules immunitaires en culture et dans des modèles murins d’occlusion coronarienne permanente et d’ischémie. L’objectif était d’observer comment procédaient les « bons » macrophages pour réparer le cœur. Ils ont tout d’abord confirmé que l’efférocytose induisait bel et bien le VEGFC : « Des preuves intrinsèques aux cellules de l’induction efférocytaire de VEGFC ont été révélées après l’ajout de cellules apoptotiques à des macrophages primaires en culture, ce qui a ensuite déclenché la transcription de VEGFC et la sécrétion de VEGFC », détaillent-ils dans leur article.
L’équipe a également observé chez les souris que les macrophages cardiaques ont provoqué l’augmentation des niveaux d’expression de VEGFC après l’infarctus du myocarde ; les souris déficientes en VEGFC ont quant à elles présenté une contractilité ventriculaire altérée, un remodelage tissulaire indésirable et une lymphangiogenèse réduite. En d’autres termes, une efférocytose défectueuse entraîne une accélération de l’insuffisance cardiaque chez la souris.
Vers une approche post-infarctus plus ciblée
Les expérimentations ont montré que l’efférocytose et l’expression de VEGFC dépendent du récepteur CD36 présent à la surface des macrophages. Cependant, les signaux moléculaires spécifiques conduisant à la transcription et à la libération de VEGFC restent inconnus.
« Notre défi consiste maintenant à trouver un moyen d’administrer le VEGFC ou d’inciter ces macrophages à induire davantage de VEGFC, afin d’accélérer le processus de réparation cardiaque », résume Edward Thorp, professeur agrégé de pathologie et de pédiatrie à la Northwestern University Feinberg School of Medicine et co-auteur de l’étude. En parallèle, les scientifiques doivent également trouver le moyen d’empêcher les « mauvais » macrophages de causer d’autres dommages au cœur et aux tissus environnants.
D’autres études comme celle-ci permettront d’expliciter davantage les processus biologiques mis en jeu en réponse à une crise cardiaque — en particulier la manière dont le processus d’efférocytose permet de déclencher la protéine VEGFC nécessaire à la réparation du muscle cardiaque.
« Nous nous efforçons de mieux comprendre l’évolution vers l’insuffisance cardiaque après une crise cardiaque, afin d’intervenir tôt et de remettre le cap sur la réparation cardiaque », conclut Guillermo Oliver, directeur du Feinberg Cardiovascular and Renal Research Institute et co-auteur de l’étude. L’insuffisance cardiaque concerne aujourd’hui environ 2,3% de la population française (et jusqu’à 10% des plus de 70 ans) ; plus de 70 000 décès sont associés chaque année à cette pathologie.