Les lésions traumatiques du système nerveux central entraînent souvent une perte importante des fonctions sensorielles, motrices et/ou visuelles. Ces lésions constituent la première cause d’invalidité dans le monde, car le tissu nerveux possède une capacité de restauration limitée. Des neuroscientifiques de la City University of Hong Kong ont toutefois identifié une molécule qui pourrait changer la donne : celle-ci est capable de stimuler efficacement la régénération nerveuse et de restaurer les fonctions visuelles après une lésion du nerf optique.
Les cellules ganglionnaires de la rétine — les neurones qui transmettent les stimuli visuels de l’œil au cerveau — ne parviennent généralement pas à régénérer les axones lésés après une blessure, ce qui entraîne une perte visuelle permanente après une lésion du nerf optique. Les axones possèdent une capacité de croissance intrinsèque, mais le processus est particulièrement exigeant en énergie : il faut former des cônes de croissance et initier un programme de repousse, impliquant la synthèse et le transport des matériaux nécessaires.
« Les photorécepteurs situés dans les yeux [la rétine] transmettent les informations visuelles aux neurones de la rétine. Pour faciliter la récupération de la fonction visuelle après une blessure, les axones des neurones doivent se régénérer à travers le nerf optique et relayer les impulsions nerveuses vers des cibles visuelles dans le cerveau via le nerf optique pour le traitement et la formation des images », a expliqué le Dr Chi-him Eddie Ma, qui a dirigé les recherches. Pour faciliter la repousse des axones, le Dr Ma et son équipe ont eu l’idée de stimuler ce processus en apportant l’énergie supplémentaire nécessaire.
Une régénération axonale « longue distance »
Ils ont identifié une petite molécule, notée M1, capable d’augmenter la fusion et la motilité des mitochondries — qui sont en quelque sorte les centrales énergétiques des cellules —, augmentant ainsi la capacité de croissance intrinsèque des neurones lésés et accélérant la régénération axonale. Testée sur des souris souffrant d’une lésion par écrasement du nerf optique, cette molécule a montré des résultats spectaculaires.
En cas de lésion, les neurones blessés nécessitent un transport « longue distance » des mitochondries, depuis le corps cellulaire jusqu’à la portion de l’axone séparée de celui-ci. Pour déterminer si M1 pouvait favoriser la régénération des axones sur de longues distances, l’équipe a évalué l’étendue de cette régénération chez les souris traitées par M1 quatre semaines après leur avoir occasionné une lésion.
Ils ont été surpris de constater que la plupart des axones régénérés atteignaient 4 mm de distance du site d’écrasement (c’est-à-dire près du chiasma optique, la partie du cerveau où les deux nerfs optiques se croisent). A contrario, pratiquement aucune régénération n’a été observée chez les souris non traitées.
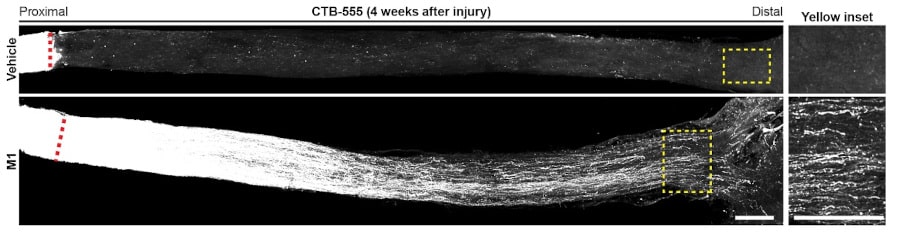
« Cela indique que le traitement par M1 soutient la régénération des axones sur une longue distance depuis le chiasma optique, c’est-à-dire à mi-chemin entre les yeux et la région cérébrale cible, vers de multiples cibles visuelles sous-corticales dans le cerveau », a déclaré le Dr Ma. Par ailleurs, les chercheurs ont constaté que le traitement à base de M1 augmentait considérablement le taux de survie des cellules ganglionnaires de la rétine : celui-ci est passé de 19% à 33% quatre semaines après la lésion du nerf optique.
Une fonction visuelle rétablie en six semaines
Non seulement les axones ainsi régénérés ont déclenché des activités neuronales dans les régions cérébrales correspondantes, mais le traitement a permis de restaurer les fonctions visuelles dans les quatre à six semaines après la lésion.
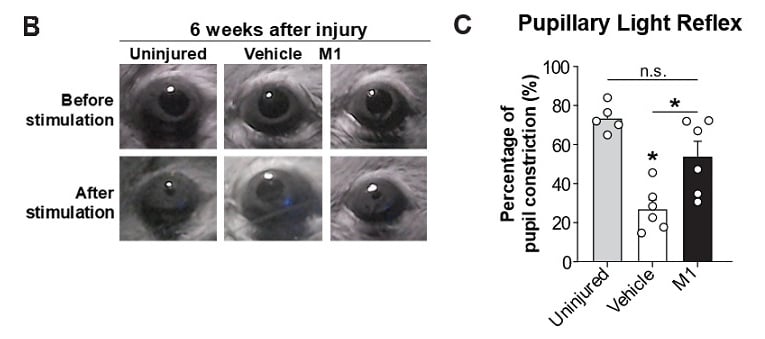
Pour évaluer les capacités de M1 à restaurer la fonction visuelle, l’équipe a soumis les souris traitées à un test de réflexe pupillaire lumineux six semaines après la lésion : ils ont alors constaté que les yeux lésés des souris traitées affichaient une réponse de constriction de la pupille à la lumière bleue quasi identique à celle observée chez les souris non lésées.
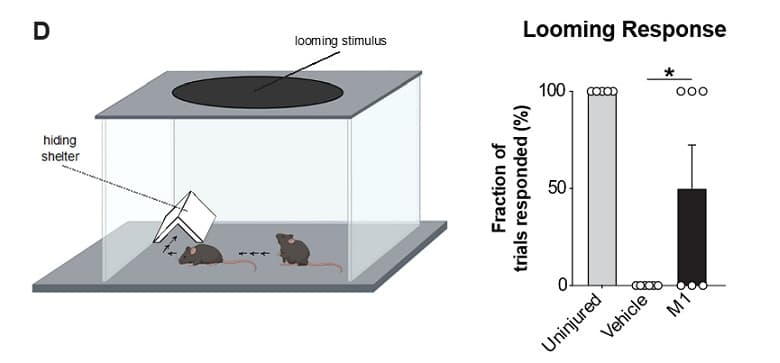
Pour confirmer leurs observations, les chercheurs ont ensuite évalué la réponse des souris à un stimulus d’approche : les souris ont été placées dans une chambre ouverte, contenant un objet sous lequel elles pouvaient s’abriter ; un cercle noir placé rapidement au-dessus de leur tête (simulant l’approche d’un prédateur) constituait le stimulus de menace. Ils ont remarqué que la moitié des souris traitées par M1 ont répondu au stimulus en se cachant sous l’abri, ce qui montre que M1 a induit une régénération robuste des axones et une récupération complète de leur fonction visuelle.
L’équipe souligne que la molécule M1 a été administrée aux souris par simple injection intravitréenne dans les yeux — une procédure médicale largement pratiquée dans le traitement de certaines pathologies rétiniennes, telles que la dégénérescence maculaire. Les résultats obtenus ouvrent ainsi la voie à une thérapie « facilement disponible » pour la réparation des lésions du nerf optique. « Cette percée dans la recherche annonce une nouvelle approche qui pourrait répondre à des besoins médicaux non satisfaits en accélérant la récupération fonctionnelle dans une fenêtre de temps thérapeutique limitée après des lésions du système nerveux central », a déclaré le Dr Ma.
L’équipe met actuellement au point un modèle animal pour déterminer si M1 se montre tout aussi efficace pour traiter la perte de vision liée au glaucome. Ils envisagent de tester les effets de la molécule sur d’autres maladies oculaires et déficiences visuelles courantes (telles que la rétinopathie liée au diabète, la dégénérescence maculaire et la neuropathie optique traumatique), afin d’évaluer l’application clinique potentielle de M1.


