En chimie, la structure est primordiale car elle détermine le comportement d’une molécule. Cependant, les deux méthodes classiques pour cartographier la structure de petites molécules organiques, telles que les produits pharmaceutiques, les hormones et les vitamines, présentent des inconvénients. Cette semaine, deux équipes de recherche ont annoncé avoir adapté une troisième technique, couramment utilisée pour cartographier des protéines beaucoup plus volumineuses, afin de déterminer la forme précise de petites molécules organiques.
La nouvelle technique fonctionne avec des échantillons extrêmement petits, est rapide et étonnamment facile. « Je suis époustouflée par cela » déclare Carolyn Bertozzi, chimiste à l’Université Stanford de Palo Alto, en Californie. « Le fait que vous puissiez obtenir ces structures d’un échantillon un million de fois plus petit qu’un grain de poussière est magnifique. C’est un nouveau jour pour la chimie ».
La référence en matière de détermination des structures chimiques a longtemps été la cristallographie aux rayons X. Un faisceau de rayons X est envoyé sur un cristal pur contenant des millions de copies d’une molécule alignées dans une seule orientation. Les chercheurs peuvent déterminer la position de chaque atome dans la molécule en étudiant la façon dont les rayons X rebondissent sur les atomes du cristal.
La cristallographie permet de déterminer des positions atomiques inférieures à 0.1 nanomètre, environ la taille d’un atome de soufre. Mais la technique fonctionne mieux avec des cristaux relativement gros, ce qui peut être difficile à fabriquer. « La plus grosse partie du temps de l’expérience est consacrée à la fabrication du cristal » explique Brian Stoltz, chimiste organique à l’Institut de technologie de Californie (Caltech) à Pasadena. « Cela peut prendre des semaines, voire des mois, ou même des années ».
Sur le même sujet :
Des molécules ont été contrôlées individuellement pendant quelques femtosecondes
La seconde approche, connue sous le nom de spectroscopie à résonance magnétique nucléaire (RMN), n’exige pas de cristaux. Elle permet d’analyser des structures en perturbant le comportement magnétique des atomes dans les molécules, puis en suivant ce comportement, lequel change en fonction des atomes voisins. Mais la RMN nécessite également une bonne quantité de matériaux de départ. Et c’est indirect, ce qui peut donc conduire à des erreurs de cartographie avec de plus grosses molécules tels que les médicaments.

La nouvelle approche s’appuie sur une technique appelée diffraction électronique, qui envoie un faisceau d’électrons à travers un cristal et, comme en cristallographie aux rayons X, détermine la structure à partir des motifs de diffraction. Cela a été particulièrement utile pour étudier la structure d’une classe de protéines imbriquées dans les membranes cellulaires. Pour ce, les chercheurs créent d’abord de minuscules cristaux en forme de feuille 2D, contenant de multiples copies d’une protéine imbriquée dans une membrane.
Mais dans de nombreux cas, la croissance des cristaux protéiques se déroule mal. Au lieu d’obtenir des feuilles à membrane unique, les chercheurs se retrouvent avec de nombreuses feuilles empilées les unes sur les autres, qui ne peuvent pas être analysées par diffraction électronique classique. Et les cristaux peuvent être trop petits pour la diffraction des rayons X.
« Nous ne savions pas quoi faire avec tous ces cristaux », déclare Tamir Gonen, expert en cristallographie électronique à l’Université de Californie, à Los Angeles (UCLA). Ainsi, son équipe a modifié la technique : au lieu de tirer leur faisceau d’électrons à partir d’une direction unique sur un cristal statique, ils ont fait pivoter le cristal et ont suivi l’évolution du diagramme de diffraction. Au lieu d’une seule image, ils ont obtenu ce qui s’apparentait davantage à une tomographie par ordinateur. Cela leur a permis d’obtenir des structures à partir de cristaux faisant un milliardième de la taille de ceux nécessaires à la cristallographie à rayons X.
Gonen explique que, comme il s’intéressait aux protéines, il n’a jamais vraiment pensé à essayer sa technique autrement. Mais plus tôt cette année, Gonen est passé du campus du Janelia Research à celui du Howard Hughes Medical Institute à Ashburn, en Virginie, à UCLA. Là, il a fait équipe avec des collègues qui souhaitaient voir si la même approche fonctionnerait non seulement avec des protéines, mais aussi avec des molécules organiques plus petites.
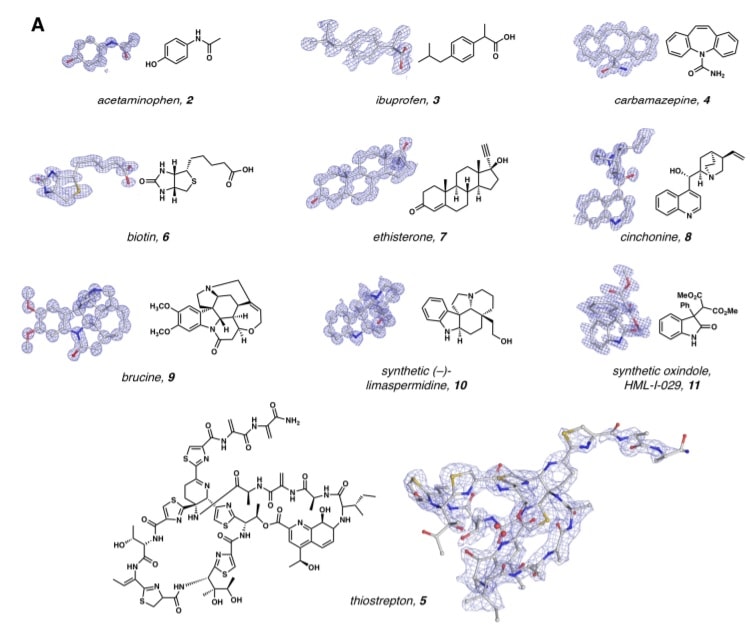


La réponse s’est révélée positive. Sur le serveur de pré-publication ChemRxiv, l’équipe californienne a annoncé mercredi que lorsqu’elle avait essayé l’approche avec de nombreux échantillons, elle fonctionnait presque à chaque fois, offrant une résolution comparable à celle de la cristallographie aux rayons X. L’équipe pouvait même obtenir des structures à partir de mélanges de composés et de matériaux qui n’avaient jamais été cristallisés formellement et qui n’avaient été que raclés sur une colonne de purification chimique.
Ces résultats ont tous été obtenus après quelques minutes seulement de préparation des échantillons et de collecte de données. De plus, une collaboration de groupes allemands et suisses a publié indépendamment, cette semaine, des résultats similaires en utilisant essentiellement la même technique.
La nouvelle technique pourrait révolutionner les domaines de recherche sur les structures moléculaires. Tim Grüne, expert en diffraction d’électrons à l’Institut Paul Scherrer de Villigen, en Suisse, qui dirigeait le groupe européen, note que les sociétés pharmaceutiques construisent d’énormes collections de composés cristallins dans lesquelles elles recherchent de nouveaux médicaments potentiels. Mais seulement environ le quart ou le tiers des composés forment des cristaux assez gros pour la cristallographie par rayons X.
Cela pourrait accélérer la recherche de médicaments prometteurs dans de minuscules échantillons de plantes et de champignons exotiques. Pour les laboratoires criminels, cela pourrait les aider à identifier rapidement les derniers dérivés de l’héroïne gangrenant les rues. Et cela pourrait même aider les autorités des Jeux olympiques à assainir le sport en facilitant la détection de quantités infimes de drogues améliorant les performances.