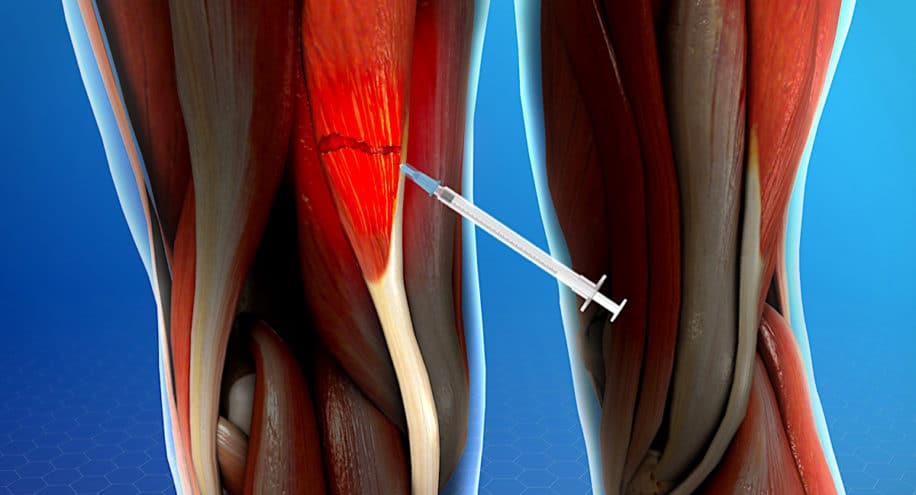
Une équipe de chercheurs espagnols a conçu un nouveau biomatériau innovant pour le traitement du tissu musculaire et la récupération fonctionnelle. Sous forme d’hydrogel, il est injecté sous la peau et permet, suite à une blessure musculaire, une récupération deux fois plus rapide.
L’hydrogel, composé d’alginate (acide alginique) chargé en bore, conçu par l’Universitat Politècnica de València (UPV) et le CIBER Bioengineering, Biomaterials and Nanomedicine (CIBER-BBN), a passé avec succès les premiers essais précliniques. Selon les résultats obtenus jusqu’à présent (sur des modèles animaux), il permet de régénérer très rapidement les muscles endommagés — deux fois plus rapidement que lorsqu’ils se régénèrent naturellement.
Et les applications ne s’arrêtent pas aux blessures musculaires : selon les chercheurs, l’hydrogel pourrait également servir à la prévention et au traitement de l’atrophie musculaire associée au vieillissement. Les résultats de l’étude ont été publiés dans la revue Materials Science & Engineering C.
Le bore, l’élément clé
« Le tissu musculaire possède un potentiel de régénération inné qui implique un processus extrêmement complexe et synchronisé, dans lequel les cellules souches musculaires résidentes jouent un rôle majeur : elles s’activent après une blessure, se différencient et fusionnent pour donner naissance à de nouvelles myofibres pour la réparation du muscle », écrivent les chercheurs dans leur document.
À en déduire du schéma de fonctionnement du processus d’aide à la guérison exploité, la clé de ce biomatériau semble être la libération du bore, dont l’hydrogel est chargé. Une fois libéré, il stimule les intégrines, des protéines présentes dans toutes les cellules du corps et jouant un rôle fondamental dans l’adhésion des cellules à la matrice extracellulaire, ce qui permet une génération correcte des tissus.
Selon l’équipe de l’UPV et du CIBER-BBN, la stimulation simultanée des intégrines qui lient la fibronectine et du transporteur d’ions de bore (NaBC1) améliore significativement la régénération musculaire au niveau anatomique. En effet, elle induit un plus grand nombre d’adhérences, et de plus grande taille, dans les cellules musculaires indifférenciées, qui sont celles qui participent à la régénération musculaire après une blessure, ce qui favorise finalement la formation de myotubes différenciés, nécessaires à la création correcte de nouvelles fibres musculaires régénératrices.
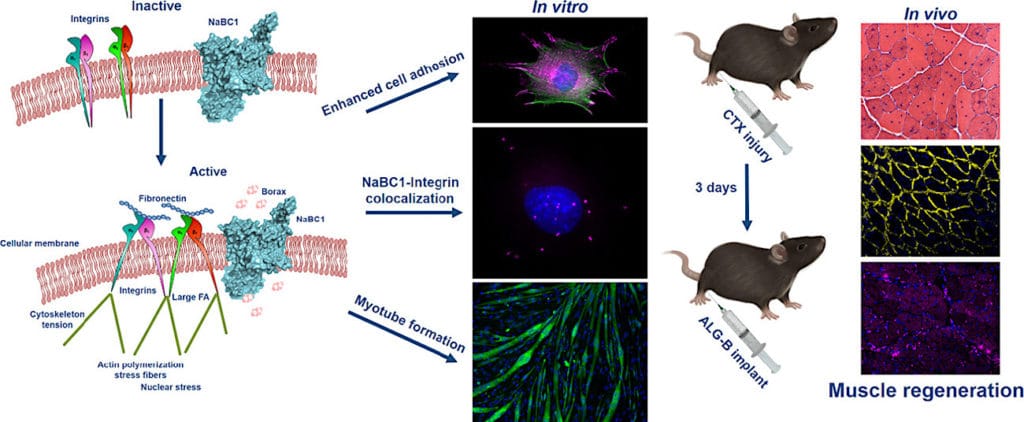
« Dans les tests que nous avons réalisés dans nos laboratoires après avoir induit une blessure aiguë avec de la cardiotoxine (du venin de cobra) chez des souris, l’activation de NaBC1 a accéléré le processus de régénération musculaire. Nous avons vérifié qu’en ajoutant du bore aux cellules musculaires endommagées, leur niveau d’adhésion augmentait et qu’elles adhéraient désormais de manière plus rapide et plus robuste, ce qui permettait au muscle de se régénérer en un temps plus court », ajoute la Dr Patricia Rico, chercheuse au Centre des biomatériaux et de l’ingénierie tissulaire de l’UPV.
Un potentiel de traitement pour les maladies héréditaires
Ainsi, ces travaux suggèrent un moyen simple et nouveau de parvenir à la régénération musculaire par l’interaction entre des récepteurs spécifiques sur la membrane cellulaire. « Si, par exemple, une déchirure fibrillaire du second degré met 30 jours à se régénérer, l’utilisation de notre hydrogel réduit le temps de récupération à 15 jours », précise Patricia Rico.
L’équipe du Dr Rico étudie actuellement les possibilités d’application de ce nouveau biomatériau au traitement des dystrophies musculaires telles que la dystrophie musculaire de Duchenne, une maladie héréditaire rare qui touche 1 enfant sur 100 000. « Notre objectif est d’évaluer les possibilités de notre système pour le traitement de cette dystrophie, qui se manifeste généralement entre deux et trois ans et qui, étant une maladie dégénérative, réduit drastiquement l’espérance de vie de ces enfants », conclut Patricia Rico.