Au cours des dernières années, l’édition génétique a connu un essor considérable grâce au développement de l’outil génétique CRISPR-Cas9. Si ce dernier s’est montré révolutionnaire dans la modification in situ du code génétique, de nombreux biologistes ont pointé du doigt son imprécision, pouvant résulter en l’introduction d’erreurs génétiques involontaires. Récemment, une équipe de biochimistes américains a développé une nouvelle technique d’édition génétique à la fois plus efficace et précise que CRISPR-Cas9. Cette méthode peut ainsi éditer le génome base par base, afin de soigner un grand nombre de maladies génétiques.
Des biologistes américains ont mis au point un nouveau système puissant d’édition du génome, qui pourrait offrir une précision et une efficacité nettement supérieures à la technique standard CRISPR actuelle. Bien que CRISPR-Cas9 soit une technologie médicale révolutionnaire ayant jeté les bases modernes de l’édition génétique, y compris de variantes associées à une maladie, son risque d’imprécision suscite depuis longtemps des inquiétudes.
Plus précisément, les chercheurs craignent que l’édition CRISPR-Cas9 présente le risque d’introduire des erreurs sous la forme d’insertions et de suppressions non contrôlées dans le code génétique, appelé indel.
Les chercheurs affirment que ce nouveau système, décrit dans la revue Nature et surnommé « l’édition principale » par ses inventeurs du Broad Institute (MIT) et de l’Université Harvard, pourrait changer la donne grâce à une nouvelle protéine qui permet la modification de haute précision de cibles génétiques.
« L’une des principales aspirations dans les sciences biomoléculaires est la capacité d’apporter précisément des modifications au génome, où qu’elles se trouvent » déclare le généticien David Liu, du Broad Institute. « Nous ne connaissons pas d’autre technologie d’édition de cellules de mammifères qui offre ce niveau de polyvalence et de précision, avec si peu de sous-produits ».
Transcriptase inverse et Cas9 : une édition génétique plus précise et polyvalente
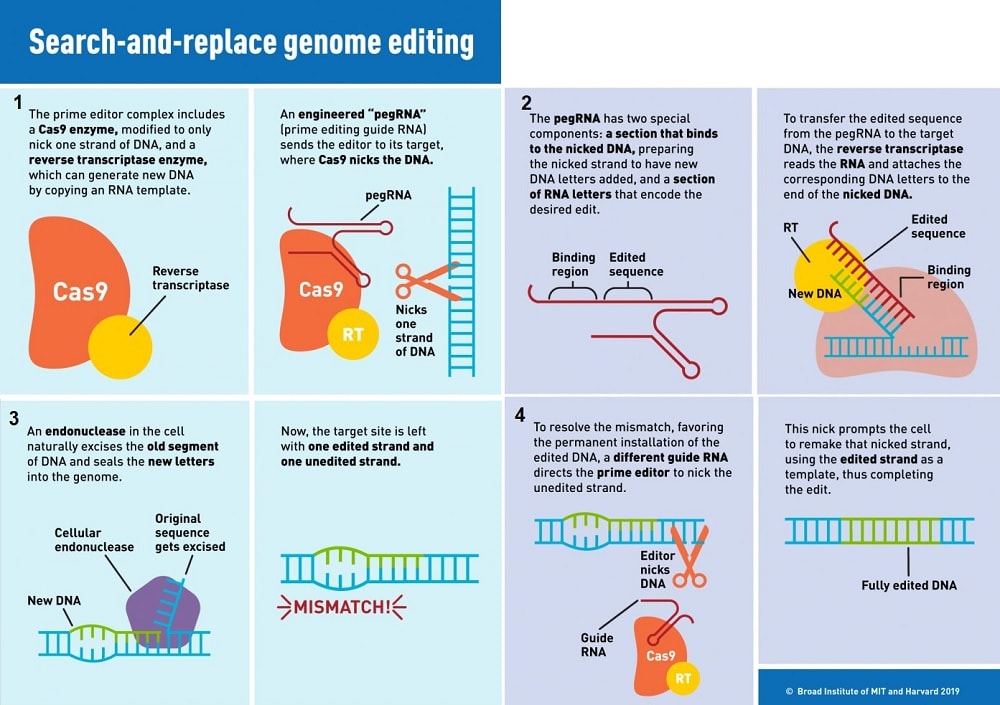
La base de la nouvelle méthode d’édition principale est une enzyme appelée transcriptase inverse. Le système CRISPR utilise également une enzyme Cas9 pour couper des brins d’ADN, de sorte que d’autres séquences génétiques puissent être insérées. Une percée réalisée en 2017 par le laboratoire de Liu a considérablement amélioré la précision du système, permettant des modifications sur une seule lettre des paires de bases d’ADN, au lieu de remplacer des portions de code entières à la fois.
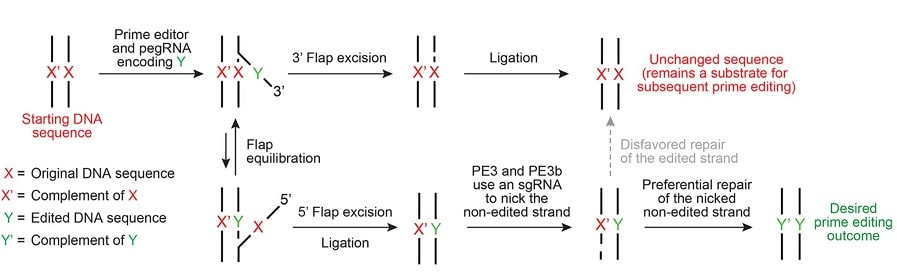
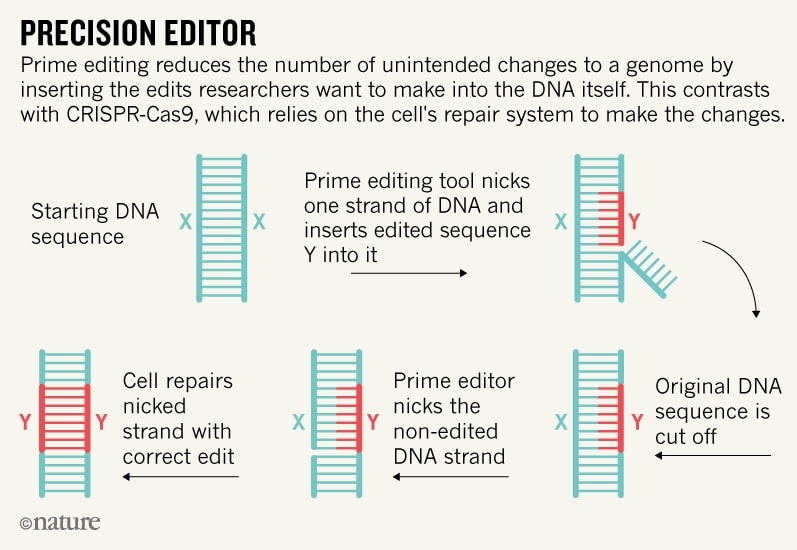
Maintenant, grâce à la transcriptase inverse, utilisée conjointement avec Cas9, l’édition génomique a été améliorée. Dans ce système, un ARN guide appelé pegRNA guide une forme modifiée de l’enzyme Cas9 pour ne couper qu’un seul brin d’ADN (empêchant les ruptures double brin pouvant induire des perturbations involontaires). Après cela, la transcriptase inverse copie directement les informations génétiques modifiées contenues dans le pegRNA sur le site génomique ciblé.
« La polyvalence de l’édition principale est rapidement devenue évidente lorsque nous avons développé cette technologie » explique le biochimiste Andrew Anzalone. « Le fait que nous puissions directement copier de nouvelles informations génétiques dans un site cible a été une révélation. Nous étions vraiment enthousiastes ».
Éditer le génome base par base pour soigner les maladies génétiques
La flexibilité du système signifie que pour la première fois, les chercheurs peuvent échanger efficacement une « lettre » d’ADN contre une autre — parmi les bases suivantes : adénine (A), cytosine (C), guanine (G) et thymine (T) — des 12 combinaisons possibles. Il s’agit d’une nette amélioration par rapport à ce que les avancées de l’éditeur de base réalisées en 2017 ont permis : des types entièrement nouveaux de modifications génétiques des maladies humaines sont désormais possibles par rapport à ce qui pouvait être fait auparavant.
« Avec l’édition principale, nous pouvons maintenant corriger directement la mutation de la drépanocytose et supprimer les quatre bases d’ADN supplémentaires qui causent la maladie de Tay Sachs, sans couper entièrement l’ADN ni avoir besoin de modèles d’ADN », explique Liu.
Sur le même sujet : Une nouvelle version révolutionnaire de CRISPR permet d’éditer de nombreux gènes simultanément
L’équipe décrit en détail ces procédures dans des tests de laboratoire, parmi plus de 175 modifications effectuées dans des cellules humaines et de souris, avec des résultats produisant moins de sous-produits indésirables et introduisant moins de modifications non ciblées que l’approche Cas9 traditionnelle. C’est une étape importante, mais compte tenu du rythme rapide auquel ces technologies évoluent, les chercheurs soulignent que la méthode n’en est qu’au début de ses possibilités.
Des opportunités biomédicales exponentielles
« De nombreuses recherches supplémentaires sont nécessaires pour mieux comprendre et améliorer l’édition principale dans un large éventail de types de cellules et d’organismes, pour évaluer l’édition principale non ciblée à l’échelle du génome et pour mieux caractériser dans quelle mesure les éditions principales peuvent affecter les cellules » écrivent les auteurs.
Néanmoins, il est clair qu’il pourrait y avoir une énorme opportunité en matière d’élargissement de l’échelle théorique et pratique de l’édition du génome — étendre la technique, en principe, à 89% des variants génétiques humains pathogènes connus, disent les chercheurs.
Les opportunités commerciales sont aussi potentiellement énormes. Les chercheurs accorderont aux autres scientifiques une licence non commerciale pour explorer cette approche, mais les applications commerciales du système en instance de brevet pourraient être plus que considérables pour ses inventeurs.
« Nous n’en sommes qu’au début, mais les premiers résultats semblent fantastiques. Vous allez voir beaucoup de gens utiliser cette nouvelle technique » conclut Brittany Adamson, généticienne à l’Université de Princeton.
Cette infographie résume le fonctionnement de la nouvelle méthode d’édition :