Selon deux nouvelles études publiées dans le Journal of Experimental Medicine, des pièges d’ADN, formés et libérés par des cellules immunitaires, pourraient être à l’origine des dommages tissulaires observés au niveau des poumons, dans les formes graves de COVID-19. Cette découverte pourrait mener à une nouvelle cible thérapeutique pour la prise en charge des formes sévères de la maladie.
De véritables réseaux d’ADN extracellulaires, des sortes de mini toiles, se formeraient en effet sous l’action des neutrophiles dans le cas des infections graves. Les groupes de chercheurs belges et brésiliens à l’origine de ce constat suggèrent ainsi que le blocage de ces pièges pourrait être une nouvelle piste de traitement, limitant les dommages pulmonaires.
Des « filaments » qui obstruent les alvéoles
De très nombreuses personnes infectées par le SARS-CoV-2 ne présentent que de légers symptômes, voire pas de symptômes du tout. En revanche, d’autres développent une réponse inflammatoire excessive, qui peut endommager les poumons et provoquer un syndrome de détresse respiratoire aiguë. Dans les cas les plus graves, le manque d’oxygène peut mener au décès du patient.
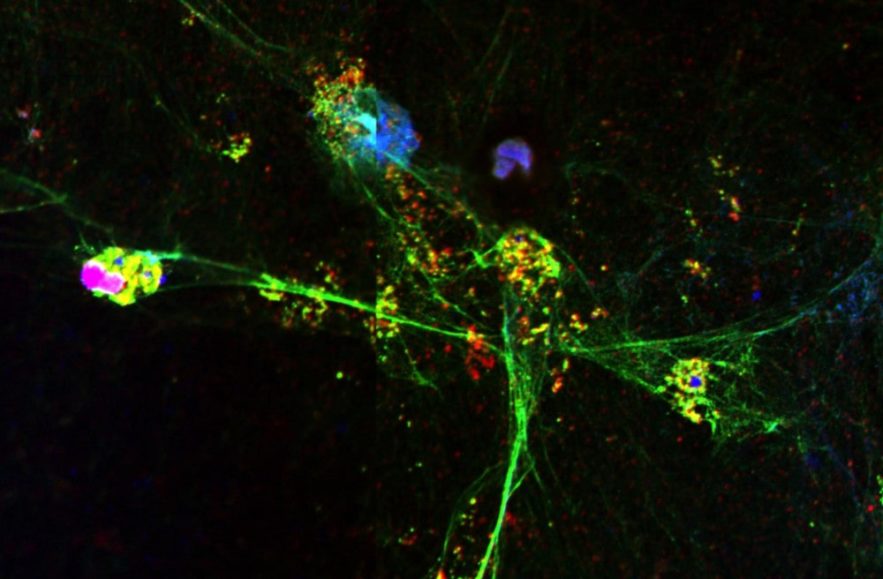
Un nombre accru de neutrophiles dans le sang et les tissus semble être un indicateur précoce de forme grave de COVID-19. Les neutrophiles sont des leucocytes (des globules blancs), produits dans la moelle osseuse, et dont le rôle est de défendre l’organisme, principalement au niveau des tissus. Les neutrophiles peuvent attraper et tuer les microbes envahisseurs en déroulant leur ADN et en l’extrudant de la cellule pour former des sortes de toiles collantes, appelées pièges extracellulaires de neutrophiles (ou NET, pour neutrophil extracellular traps).
Cependant, les NET peuvent également endommager les tissus environnants et pourraient donc être à l’origine d’une partie de la pathologie pulmonaire associée aux formes graves de COVID-19. Des chercheurs se sont donc penchés sur cet effet secondaire potentiel.
Dans l’une des nouvelles études, une équipe de l’Institut GIGA de l’Université de Liège, dirigée par Thomas Marichal, Cécile Oury et Philippe Delvenne, a examiné les poumons de quatre patients qui avaient succombé à la COVID-19 ; comparativement à d’autres échantillons pulmonaires post-mortem de patients décédés d’une cause non liée à la COVID-19, ils y ont trouvé un grand nombre de NET, dispersés dans tout l’organe. Les chercheurs ont notamment constaté que les NET colonisaient massivement le compartiment des voies respiratoires, où ils semblaient obstruer presque complètement les petites bronchioles et les alvéoles qui régulent les échanges gazeux.
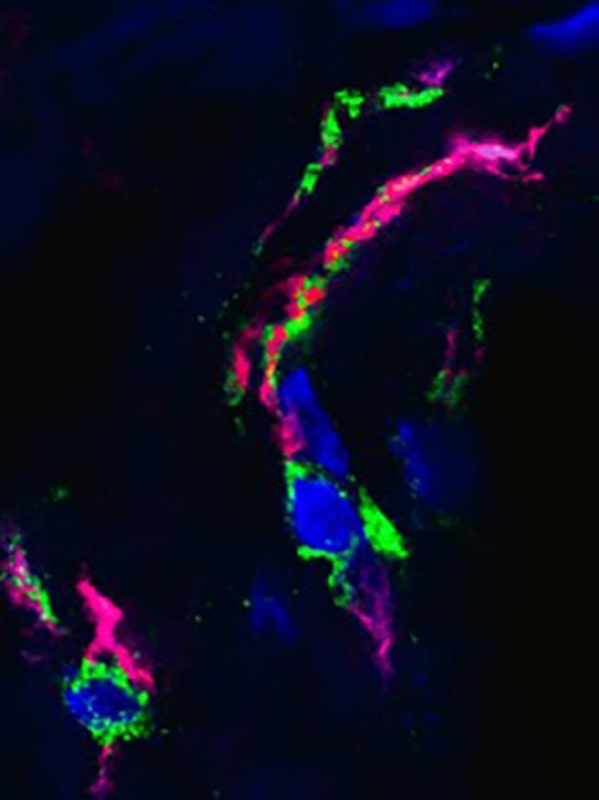
D’autres pièges s’étaient également formés sur des sites d’inflammation situés dans le compartiment interstitiel entre les alvéoles et les vaisseaux sanguins ; certains se trouvaient même dans les vaisseaux sanguins eux-mêmes, à proximité de minuscules caillots sanguins appelés microthrombus, qui peuvent restreindre la circulation sanguine dans les poumons (une autre caractéristique pathologique commune des patients sévèrement atteints de COVID-19).
Ce dernier point nécessite toutefois de plus amples recherches selon les spécialistes, afin de définir clairement le rôle de ces pièges extracellulaires : « Les NET peuvent former une plateforme pour l’adhésion des plaquettes et d’autres facteurs de coagulation sanguine, mais la contribution effective des NET à la formation de microthrombus pulmonaires associés au COVID-19 nécessitera une enquête plus approfondie », précise Thomas Marichal.
En attendant, l’équipe de l’Institut GIGA soutient que le ciblage des NET peut aider à la gestion clinique des formes sévères de COVID-19, en atténuant les événements thrombotiques, l’inflammation excessive endommageant les tissus, la fibrose et l’obstruction des voies respiratoires.
La solution : inhiber ou dégrader la synthèse des pièges
Dans le cadre d’une seconde étude sur le sujet, des chercheurs de l’Université de São Paulo ont recruté une cohorte de 32 patients hospitalisés avec un diagnostic confirmé de COVID-19, ainsi que des témoins sains. Eux aussi ont observé une augmentation notable du nombre de NET dans les poumons de patients sévèrement atteints de COVID-19. De même, ils ont pu constater que la formation de ces pièges était particulièrement élevée dans le plasma sanguin des patients COVID-19.
Sur le même sujet : Des chercheurs proposent une explication claire aux cas graves de COVID-19
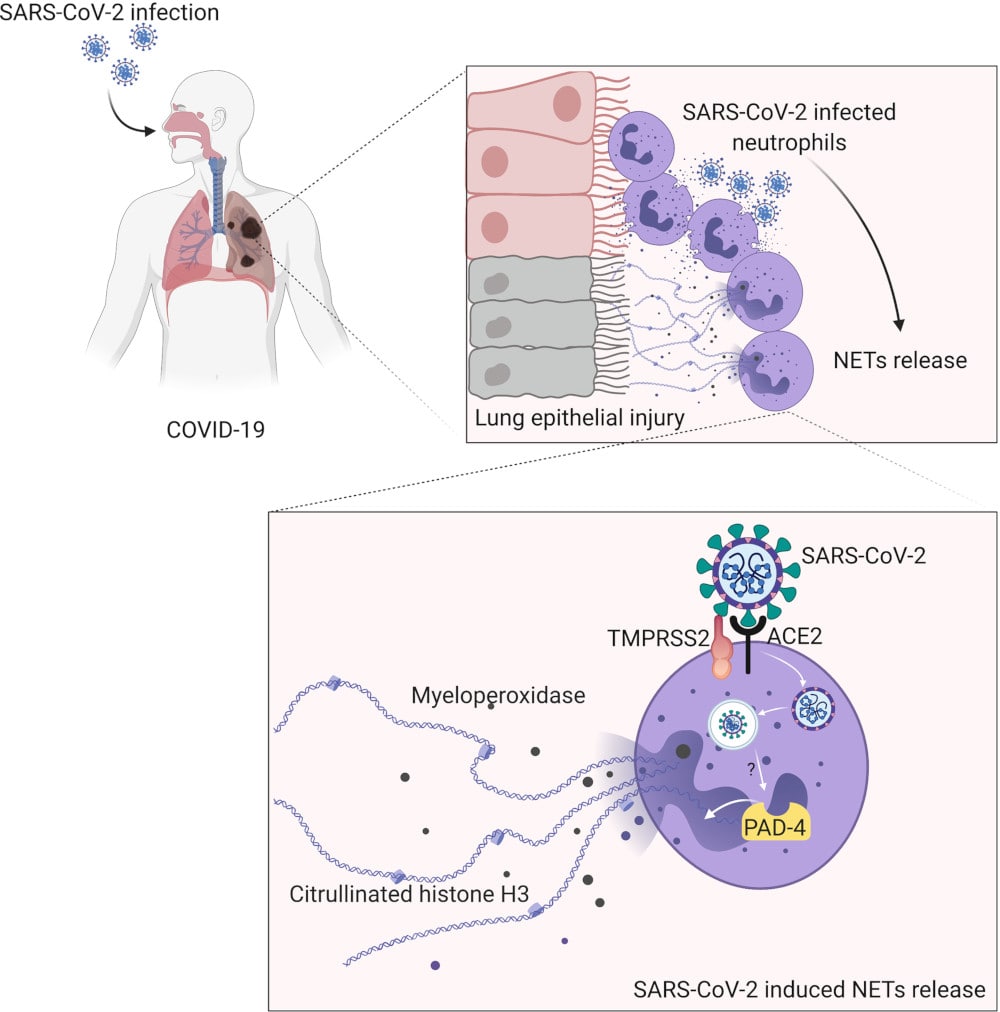
Par ailleurs, ces chercheurs ont réalisé que le virus à l’origine de la maladie, le SARS-CoV-2, était capable de déclencher la libération de NET en infectant les neutrophiles et en s’y répliquant. Une expérience sur des cellules pulmonaires cultivées en laboratoire a montré que les NET ainsi libérés par les neutrophiles infectés conduisaient à la mort des cellules. Toutefois, il est possible d’éviter la mort cellulaire en inhibant la libération de ces pièges par les neutrophiles, ou bien en les dégradant au moyen d’une enzyme capable de « mâcher » l’ADN.
Comme leurs confrères belges, cette équipe pense que cette découverte est une piste prometteuse pour limiter les dommages pulmonaires inhérents à certaines formes de COVID-19 : « Notre étude soutient l’utilisation d’inhibiteurs de la synthèse de NET, ou de promoteurs de fragmentation des NET comme stratégies pour améliorer les dommages associés aux formes sévères de COVID-19 », conclut Fernando Queiroz Cunha, l’un des auteurs principaux.