Des chercheurs chinois ont transplanté avec succès un foie de porc génétiquement modifié chez un patient humain en état de mort cérébrale, une première mondiale. Rassemblant au total 6 modifications génétiques pour minimiser les rejets immunitaires, l’organe a maintenu des fonctions métaboliques stables pendant 10 jours consécutifs. Ces résultats confirment l’intérêt des xénogreffes pour servir d’organes fonctionnels en attendant la disponibilité de donneurs humains.
La transplantation constitue le traitement le plus efficace pour les maladies hépatiques en phase terminale. Les patients souffrant d’une insuffisance hépatique aiguë peuvent effectuer une dialyse du foie et prendre des traitements médicamenteux, mais la transplantation constitue la meilleure option à long terme. Cependant, l’approche se heurte à une forte pénurie de donneurs. Le nombre de dons allogéniques est loin d’être suffisant pour répondre à la demande croissante de transplantation. Plus de 100 000 patients sont par exemple en attente d’un don d’organe rien qu’aux États-Unis.
Les xénogreffes porcines sont explorées depuis des décennies pour pallier cette pénurie, en raison de leurs fonctions physiologiques et leur taille compatibles avec l’humain. D’autre part, les avancées en matière d’édition génétique ont permis de supprimer les gènes associés au rejet de greffe hyperaigu (tels que la glycoprotéine α-galactosyltransférase 1 (GGTA1) et la cytidine monophosphate- N -acétylneuraminique hydroxylase (CMAH)) ou d’insérer des gènes humains de sorte à améliorer la compatibilité des xénogreffes.
Plusieurs essais pré-cliniques et cliniques de xénotransplantation ont été effectués à ce jour, dont des cœurs et des reins de porc transplantés avec succès chez des sujets vivants ou en état de mort cérébrale. L’année dernière, des chercheurs ont réalisé une perfusion hépatique externe à partir d’un foie de porc génétiquement modifié chez une personne en état de mort cérébrale et présentant une insuffisance hépatique. Il s’agit de la première utilisation d’un foie porcin pour le traitement d’une maladie humaine.
Cependant, la xénotransplantation d’un foie complet n’a encore jamais été réalisée à l’intérieur d’un organisme humain en raison de la complexité de la fonction hépatique. Alors que des chercheurs ont enregistré un certain succès pour la transplantation de reins ou de cœurs porcins chez l’homme, la transplantation de foie est nettement plus complexe.
« Le cœur se contente de pomper le sang. La principale fonction du rein est de produire l’urine. Le foie a de nombreuses fonctions », explique à CNN Lin Wang, chirurgien au service de chirurgie hépatobiliaire de l’hôpital Xijing de Xi’an, en Chine. Il filtre par exemple le sang pour éliminer les toxines (telles que l’alcool et les drogues) et les déchets, produit de la bile pour faciliter la digestion, produit des protéines de coagulation sanguines, etc.
L’équipe de Wang a réalisé une étape importante en effectuant la première transplantation de foie de porc génétiquement modifié chez un humain en état de mort cérébrale. « Je pense que cela nous aidera à comprendre comment faire progresser la xénotransplantation hépatique. Car nous avons besoin de plus de travaux de ce type », estime Shimul Shah, expert en xénotransplantation et chef de division de transplantation abdominale au département intégré de chirurgie du Mass General Brigham. Shah n’a pas participé à l’étude de Wang, mais fait partie de l’équipe qui a réalisé la xénotransplantation de rein de porc chez un humain vivant.
Une fonction hépatique stable pendant 10 jours
Pour effectuer la xénotransplantation hépatique, les chercheurs ont effectué 6 modifications génétiques distinctes visant à minimiser les rejets immunitaires. Ces modifications incluaient à la fois la suppression de gènes associés au rejet hyperaigu et l’insertion de gènes humains pour améliorer la compatibilité de l’organe. L’intervention consistait en une transplantation auxiliaire hétérotopique, c’est-à-dire que l’organe a été inséré à côté du foie d’origine.
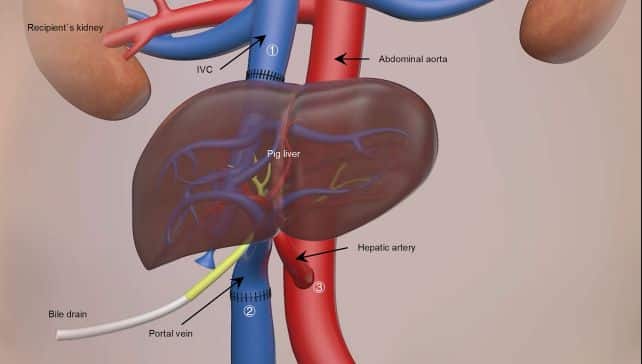
La fonction du greffon, l’hémodynamique et les réponses immunitaires et inflammatoires du receveur ont été surveillées au cours des 10 jours suivant l’intervention. Le suivi a été suspendu après ce délai à la demande de la famille du patient. Ce dernier a également reçu un traitement immunosuppresseur en parallèle inhibant l’activité des lymphocytes T et B.
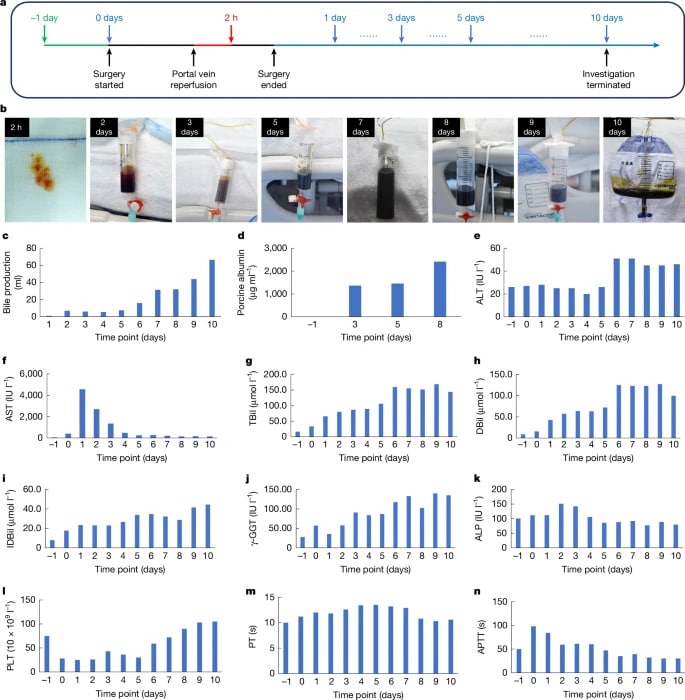
D’après les résultats détaillés dans la revue Nature, les fonctions de l’organe porcin sont demeurées globalement stables jusqu’à la fin du suivi. La vitesse du flux sanguin dans l’artère hépatique et les veines portes ont été maintenues à un niveau satisfaisant. Et bien que le nombre de plaquettes ait diminué après l’intervention, il est rapidement revenu à la normale. Les analyses histologiques ont également montré que le foie porcin s’est régénéré efficacement sans aucun signe de rejet immunitaire.
D’autre part, de la bile a été produite dès deux heures après la reperfusion de la veine porte de la xénogreffe, atteignant 66,5 ml au 10e jour. Le niveau d’albumine a également augmenté après l’intervention, tandis que les taux d’aminotransférases sont restés normaux. Ces substances sont des marqueurs clés de la fonction hépatique.


Toutefois, étant donné que le patient conservait son foie d’origine, qui était encore fonctionnel, il est difficile déterminer si celui transplanté pourrait soutenir un patient souffrant d’insuffisance hépatique. En outre, Wang admet lui-même qu’il n’était pas encore sûr qu’un foie de porc puisse un jour remplacer complètement celui d’un humain, car le volume de matière produit par ce foie pourrait ne pas suffire aux besoins du corps humain.
Néanmoins, l’approche pourrait potentiellement fournir un soutien vital aux patients en attente de donneurs d’organe et dont la transplantation est la seule option. « On ne peut pas prélever le foie de quelqu’un sans lui donner un organe fonctionnel en attendant », conclut Shah.