Les vaccins sont revenus sur le devant de la scène scientifique lors de la pandémie de COVID-19. Nos connaissances sur notre système immunitaire et les mécanismes impliqués sont cependant toujours limités, malgré des avancées indéniables. Néanmoins, les différences de réaction des organismes (de différents individus) face à un même virus rendent la tâche particulièrement difficile quant à la mise au point d’un vaccin, par exemple. En effet, pourquoi certaines personnes ne présentent-elles aucun symptôme lorsqu’elles sont infectées par le SARS-CoV-2 alors que d’autres souffrent de forte fièvre et de courbatures ? Des chercheurs du Wyss Institute de Harvard ont créé un modèle plus précis du système immunitaire humain dans une puce microfluidique, offrant une meilleure plate-forme pour étudier comment les cellules immunitaires réagissent aux vaccins et aux agents pathogènes. Explications.
De nouveaux vaccins et immunothérapies sont actuellement évalués sur des modèles animaux, ce qui peut entraîner des toxicités imprévues ou une faible efficacité dans les essais cliniques sur l’Homme, en raison de différences entre espèces dans les réponses immunitaires. Certes, des expériences précliniques peuvent être menées in vitro en utilisant des cellules immunitaires humaines prélevées dans le sang ; cependant, même ces résultats ne parviennent souvent pas à prédire les réactions des patients.
L’une des principales raisons de cet échec est que les réponses immunitaires in vivo se produisent généralement dans le microenvironnement tissulaire hautement spécialisé des follicules lymphoïdes. Ce sont de petites masses de tissus contenant des lymphocytes B et T naïfs, qui, ensemble, initient la cascade d’événements qui conduit à une réponse immunitaire complète, lorsqu’elles sont exposées à un antigène spécifique. Ils existent normalement au niveau des organes lymphoïdes secondaires tels que les ganglions lymphatiques. Mais ils peuvent se former de manière ectopique (dans d’autres organes) à la suite d’une inflammation. C’est la compréhension de cette réponse immunitaire adaptative qui est en jeu dans la mise en place de vaccins ou d’immunothérapies, chez les humains. Comment avoir accès à ces mécanismes qui dépendent du tissu environnant ?
Ces dernières années, les scientifiques ont développé un moyen de modéliser les organes et autres tissus corporels dans des puces microfluidiques, qui permettent une comparaison beaucoup plus étroite. Une puce microfluidique est un ensemble de microcanaux gravés ou moulés dans un matériau (verre, silicium ou polymère). Les microcanaux sont reliés entre eux de manière à répondre à une fonction précise (tri, pompage, mélange, etc.). Ces « organes sur puces » ou « Organ-On-Chip » (OOC) comprenaient jusqu’à présent le cœur, les poumons, les intestins, les reins, la rate, la cornée, les dents et le placenta.
La Defense Advanced Research Projects Agency, agence du département de la Défense des États-Unis chargée de la recherche et développement des nouvelles technologies destinées à un usage militaire, a soutenu l’ingénierie d’un instrument qui relie fluidiquement plusieurs OOC pour créer un corps sur puce. Ce dernier devrait permettre d’étudier l’impact des médicaments sur plusieurs systèmes d’organes simultanément. Récemment, les chercheurs de Wyss Institute for Biologically Inspired Engineering de l’Université Harvard, également soutenus par ce département de la Défense américaine, ont ajouté le système immunitaire à la liste de ces OOC. Leur recherche est publiée dans la revue Advanced Science.
Une découverte inattendue
Avant cette prouesse technologique, l’équipe de Goyal voulait simplement étudier comment les lymphocytes B et T, circulant dans le sang, modifient leur comportement une fois à l’intérieur d’un tissu. Dans cet objectif, ils ont cultivé ces cellules immunitaires, à partir d’échantillons de sang humain, à l’intérieur d’un dispositif microfluidique, conçu pour imiter les conditions physiques qu’elles rencontrent lorsqu’elles atteignent un organe.

Mais, lorsque les chercheurs ont introduit un flux de nutriments, ils ont découvert quelque chose d’inattendu. Les cellules B et T ont commencé à s’organiser en structures tridimensionnelles qui ressemblaient à des follicules lymphoïdes et, plus précisément, ils semblaient former des centres germinatifs, qui effectuent des réactions immunitaires complexes.
Goyal, immunologiste au Wyss Institute et auteur principal de l’étude, déclare dans un communiqué : « C’était tellement inattendu que nous nous sommes complètement détournés de l’expérience originale et nous nous sommes concentrés sur cette découverte ».
C’est ainsi qu’en sondant les structures formées, ils ont pu observer qu’elles sécrétaient une substance chimique appelée CXCL13. Cette dernière est produite par les follicules lymphoïdes en réponse à une inflammation chronique. De plus, les cellules B, à l’intérieur des structures, exprimaient une enzyme appelée cytidine désaminase induite par l’activation (AID), essentielle pour activer les lymphocytes B contre des antigènes spécifiques. Cette enzyme n’est pas présente dans les lymphocytes B circulant dans le sang. Ni CXCL13 ni AID n’étaient présents dans les cellules cultivées hors de ces puces, ce qui suggère que les scientifiques ont en effet réussi à créer des follicules lymphoïdes fonctionnels à partir de cellules sanguines en circulation.
Ils ont également trouvé des plasmocytes dans lesquels les cellules B matures se différencient afin de sécréter des anticorps, après leur avoir appliqué plusieurs stimuli, comme la combinaison de la cytokine IL-4 et d’un anticorps anti-CD40, ou des bactéries mortes.
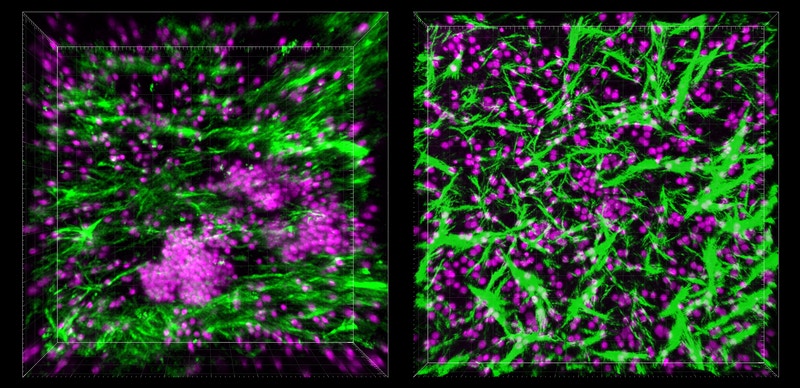
Pranav Prabhala, technicien au Wyss Institute et co-auteur de l’article, précise : « Ces découvertes étaient particulièrement excitantes, car elles ont confirmé que nous disposions d’un modèle fonctionnel qui pourrait être utilisé pour démêler certaines des complexités du système immunitaire humain, y compris ses réponses à plusieurs types d’agents pathogènes ».
Un outil pour prédire l’efficacité des vaccins
Dans un second temps, disposant d’un modèle de follicules lymphoïdes fonctionnel et capable de déclencher une réponse immunitaire, ils ont cherché à savoir comment ce dernier répondrait à la vaccination. C’est pourquoi l’équipe a ajouté des cellules dendritiques. En effet, dans le corps, elles aident à produire des antigènes, en présentant des fragments d’agents pathogènes aux ganglions lymphatiques. Puis, ils ont vacciné ce système immunitaire sur puce contre la souche de grippe H5N1 soit seul, soit avec un adjuvant, appelé SWE — connu pour stimuler les réponses immunitaires au vaccin. Les puces ayant reçu le vaccin et l’adjuvant ont produit beaucoup plus de plasmocytes et d’anticorps contre la grippe que ceux cultivés dans les boîtes de cultures habituelles, et même par rapport à ceux ayant seulement reçu le vaccin sans l’adjuvant.
Cela indique que ces puces microfluidiques de follicules lymphoïdes correspondent étroitement à la réalité. Elles pourraient constituer un modèle bien plus similaire au corps humain, pour les recherches futures sur le système immunitaire et le développement de médicaments.
Les chercheurs de Wyss utilisent désormais leurs puces de follicules lymphoïdes pour tester divers vaccins et adjuvants en collaboration avec des sociétés pharmaceutiques et la Fondation Gates.
G. Goyal conclut : « Les animaux ont été les modèles de recherche de référence pour développer et tester de nouveaux vaccins, mais leur système immunitaire diffère considérablement du nôtre et ne prédit pas avec précision comment les humains y répondront. Notre puce [de follicules lymphoïdes] offre un moyen de modéliser la chorégraphie complexe de réponses immunitaires humaines à l’infection et à la vaccination, et pourrait accélérer considérablement le rythme et la qualité de la création de vaccins à l’avenir ».


