En analysant le génome du rat-taupe nu, des chercheurs ont identifié une enzyme dont quatre modifications clés pourraient expliquer leur longévité exceptionnelle. Si des enzymes équivalentes régulent la réparation de l’ADN chez l’Homme et la souris, elle est modifiée et améliorée chez le rat-taupe nu pour réparer efficacement les dommages génétiques liés au vieillissement. Ces résultats pourraient un jour contribuer au développement de thérapies géniques ciblant cette enzyme chez l’humain.
Originaire de la Corne d’Afrique (la péninsule de l’Afrique de l’Est qui s’étend depuis la côte sud de la mer Rouge jusqu’à la côte ouest de la mer d’Arabie) et de certaines régions du Kenya, le rat-taupe nu (Heterocephalus glaber) fascine les biologistes depuis des décennies en raison de sa longévité exceptionnelle. Ces rongeurs fouisseurs peuvent notamment vivre jusqu’à 37 ans, soit près de dix fois plus longtemps que leurs congénères de taille similaire.
Les recherches suggèrent que cette longévité résulte d’une combinaison d’adaptations influençant différents processus biologiques qui favorisent la stabilité de leur génome. Les dommages à l’ADN constituent en effet l’un des principaux facteurs de vieillissement chez les animaux, y compris les humains. Si ces altérations ne sont pas réparées, elles s’accumulent et provoquent à terme des dysfonctionnements dans l’ensemble de l’organisme.
En particulier, l’accumulation de mutations génétiques délétères et de dommages à l’ADN au cours de la division cellulaire constitue un important facteur de risque pour les maladies liées à l’âge et le vieillissement. Ces dysfonctionnements sont provoqués par l’altération d’un processus naturel de réparation appelé « recombinaison homologue ». La perturbation de ce processus est par exemple observée chez les personnes souffrant de cancer ou de vieillissement prématuré.
Chez le rat-taupe nu, la recombinaison homologue semble particulièrement efficace, ce qui leur confère une stabilité génomique presque tout au long de leur vie. Cependant, les mécanismes biomoléculaires sous-tendant cette protection contre l’instabilité génomique demeurent mal compris. Le rat-taupe nu partage certains traits génétiques et physiologiques uniques, mais il n’est pas plus proche génétiquement de l’humain que la souris. Il constitue néanmoins un modèle privilégié pour étudier le vieillissement et la longévité chez les mammifères.
Un gain de longévité de 10 jours chez la drosophile
Chez les mammifères, une enzyme appelée cGAS (cyclic GMP-AMP synthase) joue un rôle dans la détection des dommages à l’ADN et la signalisation immunitaire. Chez les humains et les souris vieillissants, l’activité de la protéine cGAS est inhibée ou retirée des sites de réparation par une autre protéine pendant la recombinaison homologue, entravant ainsi les tentatives de réparation.
Dans le cadre d’une étude récemment publiée dans la revue Science, une équipe de l’Université Tongji de Shanghai, en Chine, a cherché à déterminer si un processus similaire se produisait chez les rats-taupes nus. En comparant leur cGAS avec celle des humains et des souris, les chercheurs ont identifié quatre modifications clés améliorant leur capacité à réparer les dommages à l’ADN liés au vieillissement.
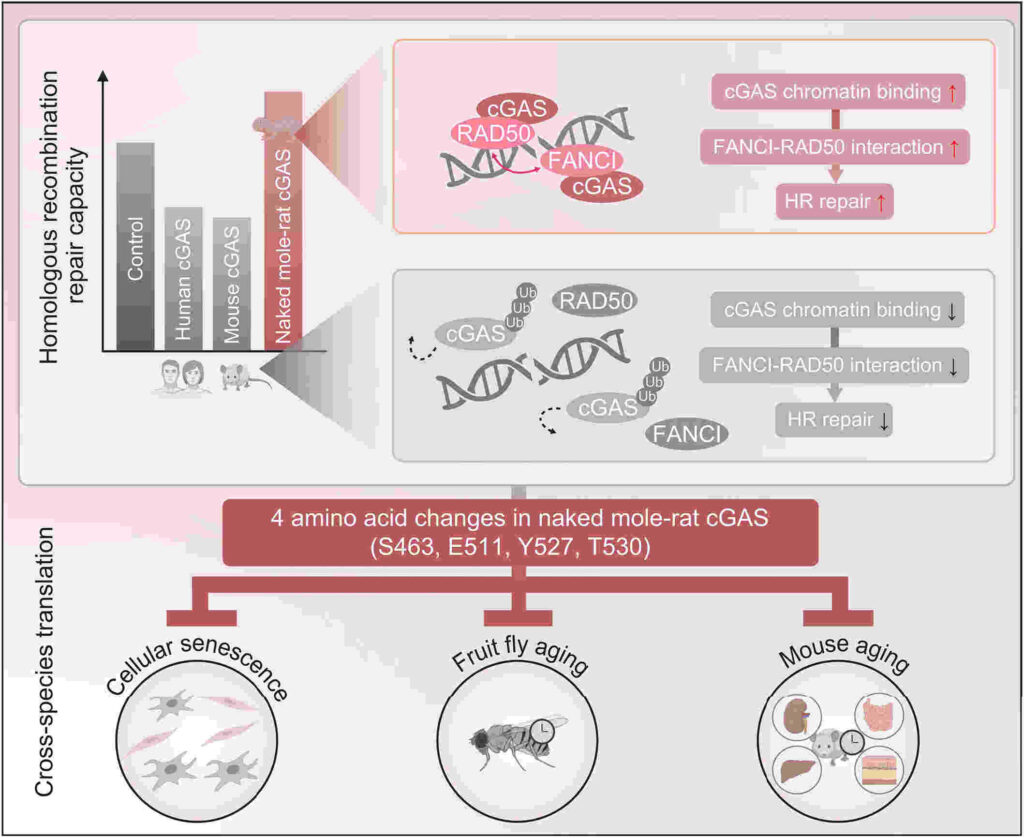
Plus précisément, ces modifications se manifestent par la substitution d’acides aminés spécifiques empêchant l’enzyme de se dégrader trop rapidement à la suite d’un dommage à l’ADN. « Nous avons constaté que la cGAS de rat-taupe nu, contrairement à la cGAS humaine et murine, améliorait l’efficacité de la réparation de la recombinaison homologue », expliquent les chercheurs dans l’étude.
« Cette inversion fonctionnelle est médiée par la substitution de quatre résidus d’acides aminés spécifiques dans le domaine C-terminal de la protéine cGAS », indiquent-ils. Autrement dit, l’enzyme du rat-taupe nu persiste suffisamment longtemps pour adhérer efficacement aux protéines spécifiques de réparation de l’ADN.
Pour évaluer les effets directs de la cGAS du rat-taupe nu, l’équipe a modifié génétiquement des cellules isolées pour éliminer le gène à l’aide de l’outil d’édition génétique CRISPR-Cas9. Ils ont également modifié génétiquement des drosophiles (ou mouches du vinaigre) pour exprimer soit une version de la cGAS humaine contenant les quatre mutations spécifiques du rat-taupe, soit une version de la cGAS humaine sans mutations.
Les analyses ont révélé qu’en l’absence du gène cGAS, les dommages à l’ADN au niveau des cellules se sont accumulés de manière exponentielle. En revanche, les drosophiles exprimant la cGAS portant les quatre mutations vivaient nettement plus longtemps (dix jours de plus) que celles dépourvues des mutations.
Vers des pistes thérapeutiques potentielles
Dans une autre expérience, les chercheurs ont utilisé la thérapie génique pour administrer la cGAS de rat-taupe nu à des souris. Ils ont constaté que les souris traitées présentaient un score de fragilité réduit par rapport aux témoins, avaient moins de poils gris et affichaient une diminution du nombre de cellules vieillissantes dans leurs organes.
Les résultats suggèrent que « les mutations confèrent au cGAS du rat-taupe nu une plus grande capacité à stabiliser le génome, à contrer la sénescence cellulaire et le vieillissement des organes, et à favoriser une durée de vie et une santé prolongées », écrivent les chercheurs.
Toutefois, il faut garder à l’esprit que si le gène cGAS pourrait servir de cible potentielle pour favoriser la réparation du génome, davantage de recherches seront encore nécessaires avant de pouvoir transposer ces résultats à des traitements contre le vieillissement. Néanmoins, ils pourraient déjà ouvrir la voie à de nouvelles pistes pour les thérapies contre les maladies liées à l’âge.


