Au cours des dernières années, la biologie synthétique a évolué de manière à permettre aujourd’hui aux scientifiques de cultiver des organes et des tissus artificiels afin de pouvoir étudier ces structures biologiques in vitro, sans avoir à pratiquer des examens directs sur l’Homme. Récemment, des biologistes ont réussi à cultiver des rétines humaines, une étape clé dans la recherche contre certaines maladies de l’œil encore mal comprises.
Même si le processus de la vision, chez l’humain, est étudié depuis de nombreuses années, tous ses mécanismes sous-jacents ne sont pas totalement compris. Pour remédier à cela, des neuroscientifiques et des médecins américains ont cultivé des rétines humaines en laboratoire dans le but de mieux comprendre la gestion des couleurs par le bloc optique de l’œil. Les résultats de cette recherche ont été publiés dans la revue Science.
Ces travaux pourraient ouvrir la voie à de nouvelles thérapies concernant des pathologies de l’œil comme la perte des couleurs ou la dégénérescence maculaire. Ils confortent également les organoïdes — des tissus organiques artificiels — comme modèles efficaces d’étude des mécanismes biologiques à l’échelle cellulaire.
Sur le même sujet :
Quatre patients testent un implant rétinien qui pourrait empêcher la cécité liée à l’âge
« Tout ce que nous examinons dans un organoïde rétinien est identique à un œil normal en développement, sauf qu’il est cultivé en laboratoire » explique Robert Johnston, biologiste du développement à l’université John Hopkins. « Vous avez un modèle systémique que vous pouvez manipuler sans devoir étudier directement l’humain ».
Des cellules souches aux cellules spécialisées : comprendre comment la fonction des cellules est déterminée
L’équipe de Johnston explore la manière dont les cellules évoluent — les facteurs qui déterminent en quelle cellule fonctionnelle se transforme une cellule souche. Dans leurs recherches, les scientifiques se sont penchés sur le développement des cellules permettant de distinguer les couleurs bleu, vert et rouge. C’est-à-dire les trois photorécepteurs coniques de l’œil humain. Alors que la majorité des recherches sur la vision sont menées sur des souris et des poissons, aucune de ces espèces n’a la vision dynamique des contrastes et couleurs de l’Homme.
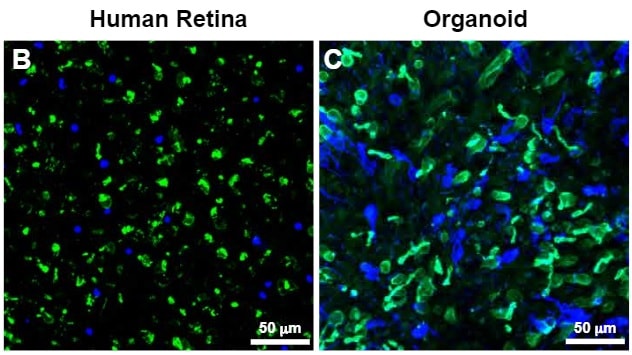
Jonhston et ses collègues ont donc cultivé les rétines humaines dont ils avaient besoin. « La vision trichromatique des couleurs nous différencie de la plupart des autres mammifères » ajoute Kiara Eldred, doctorant en neurobiologie. « Nos recherches tentent véritablement de découvrir quelle voie suivent ces cellules pour nous conférer notre vision si particulière ».
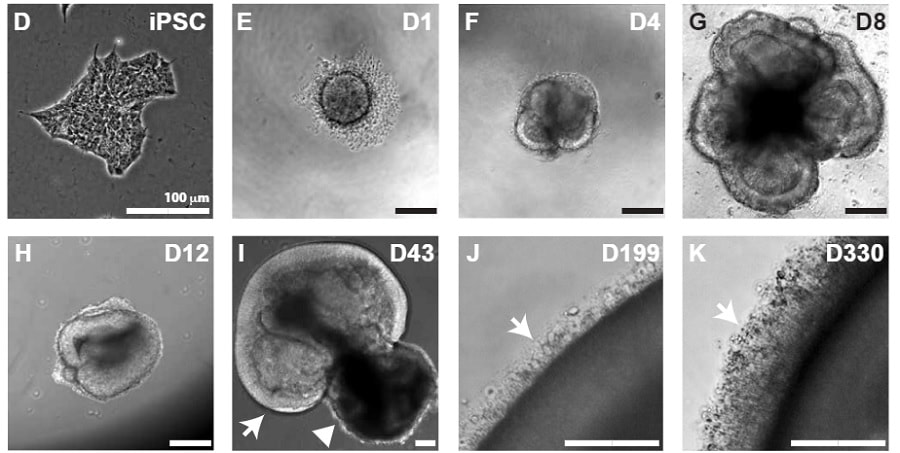
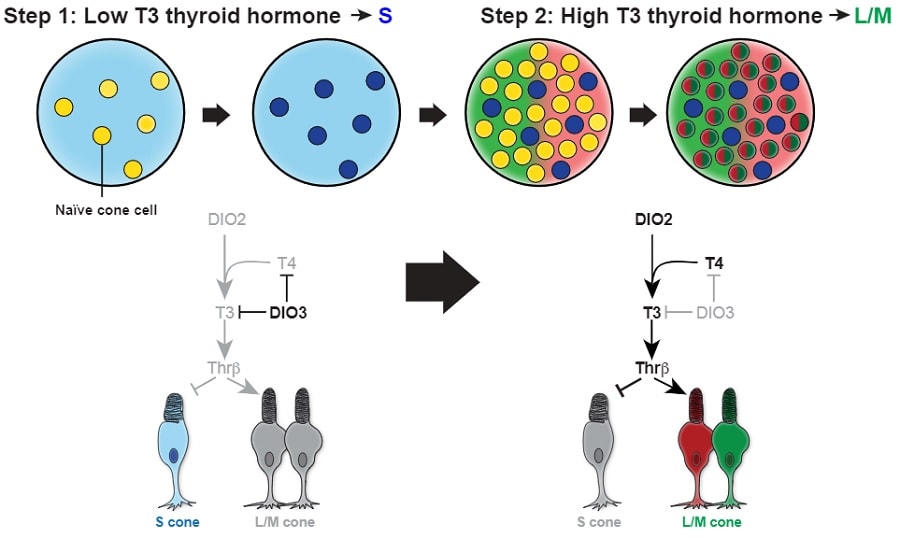
Au cours des mois, tandis que les cellules ont évolué en laboratoire pour devenir des tissus rétiniens pleinement fonctionnels, les scientifiques ont découvert que les cônes chromatiques bleus apparaissaient en premier, suivies par les rouges et verts. L’analyse a montré que les mécanismes moléculaires impliqués dans cette différentiation étaient régulés par les hormones thyroïdiennes.
Plus important encore, la glande thyroïde, qui n’était pas dans la boîte de pétri, ne contrôlait pas les niveaux d’hormones thyroïdiennes ; c’était le tissu rétinien qui assurait ce contrôle.
Vision et hormones thyroïdiennes : une étape clé dans la compréhension des maladies de l’œil
Une fois que les chercheurs ont compris comment les niveaux d’hormones thyroïdiennes induisaient la différenciation en photorécepteurs bleu ou rouge et vert, ils ont pu contrôler ces mécanismes et créer des rétines qui — si elles faisaient partie d’un système optique humain complet — n’auraient permis de voir qu’en bleu, ou en rouge et vert.
Le fait d’avoir découvert que les hormones thyroïdiennes sont essentielles au développement des cônes rouge-vert offre des pistes pour comprendre pourquoi les bébés prématurés, ayant des niveaux d’hormones thyroïdiennes plus bas, ont plus de risques de développer des troubles de la vision. « Si nous comprenons ce qui conduit une cellule jusqu’à son évolution finale, nous nous rapprochons de la possibilité de restaurer la vision des couleurs chez les personnes ayant des photorécepteurs endommagés » explique Eldred.


Dans le futur, les chercheurs ambitionnent de créer des organoïdes plus complets afin d’étudier d’autres parties de l’œil humain, comme la macula. Puisque la dégénérescence maculaire est la cause majoritaire de cécité chez l’humain, cultiver des maculas pourrait révolutionner les traitements contre cette maladie.
« Ce qui est vraiment passionnant c’est que nos travaux établissent les organoïdes humains comme d’excellents modèles d’étude des mécanismes du développement humain. Ces organoïdes mettent neuf mois à se développer complètement, tout comme un bébé humain. Donc, nous pouvons étudier un vrai développement fœtal » conclut Jonhston.