Tandis que la collaboration Pfizer-BioNTech vient de faire sensation avec son vaccin à ARNm efficace à 90%, c’est au tour de la Russie de surenchérir. Le Sputnik V, vaccin anti-COVID-19 développé par les Russes, serait encore plus puissant.
Le Fonds souverain russe a déclaré mercredi, le 11 novembre, qu’une analyse précoce des données tirées des essais cliniques de son vaccin contre le coronavirus suggère qu’il est efficace à 92%. Alors que les résultats de Pfizer restent à corroborer par la communauté scientifique et que les analyses doivent se poursuivre, cette surenchère est presque risible. À nouveau, certains scientifiques appellent à la prudence, notant que les données sont loin d’être concluantes.
Une analyse basée sur une vingtaine de cas
Début août, Vladimir Poutine annonçait que son pays avait réussi à développer le tout premier vaccin contre la COVID-19 — alors même que les essais de phase 3 n’étaient pas terminés. Baptisée Sputnik V, la formule serait « assez efficace » et conférerait une « immunité durable », selon les mots employés par le président russe cet été. Ce vaccin a été développé par l’Institut Gamaleïa de Moscou ; le Fonds d’investissement direct russe (ou RDIF) a financé sa production et prendra en charge sa commercialisation dans le monde entier.
Tout comme le duo concurrent Pfizer-BioNTech, les Russes ont attendu qu’un nombre suffisant de participants à l’essai de phase 3 de leur vaccin contractent la maladie avant de procéder aux premières analyses. Actuellement, 40’000 volontaires participent à cette étude clinique ; parmi eux, les chercheurs ont identifié 20 cas de COVID-19, parmi lesquels certains — visiblement une grande partie — ont reçu un placebo au lieu du vaccin. Pour rappel, la collaboration germano-américaine avait, quant à elle, basé ses résultats préliminaires sur 94 cas.
Le RDIF a déclaré qu’aucun événement indésirable n’avait été observé lors de l’essai de phase 3. Seuls quelques effets secondaires mineurs ont été rapportés par les participants ayant reçu une dose du vaccin, tels que des douleurs au niveau du site de l’injection ou de légers symptômes pseudogrippaux (fièvre, fatigue, faiblesse et maux de tête). Plus de 20’000 personnes ont reçu une première dose de vaccin et plus de 16’000 ont reçu une deuxième dose. Cet essai de phase 3 se poursuivra pendant six mois supplémentaires et le RDIF a affirmé que les données associées seront publiées dans une revue médicale internationale, après un examen par les pairs.
À noter qu’en parallèle de cet essai clinique, le Sputnik V a d’ores et déjà été administré, en septembre, à certains membres du personnel hospitalier, localisés dans les régions les plus touchées par le virus, mais aussi à des groupes à risque ou d’autres volontaires. Selon le RDIF, « l’analyse de l’utilisation civile du vaccin en dehors des essais cliniques, basée sur l’observation de 10’000 personnes vaccinées, a également montré une efficacité du vaccin supérieure à 90% ».
L’annonce suscite évidemment pas mal de scepticisme parmi la communauté scientifique. Le nombre de cas considérés pour établir ce pourcentage est jugé insuffisant : « Intuitivement, cela n’a pas de sens de revendiquer une protection de 92% uniquement sur la base de 20 événements », souligne le Dr Peter Hotez, spécialiste des maladies infectieuses au Baylor College of Medicine, qui développe également un vaccin contre le coronavirus. Comme dans le cas du vaccin de Pfizer-BioNTech, les autorités de régulation telles que l’Agence européenne des médicaments, devront examiner minutieusement les données des essais cliniques avant de prendre la moindre décision.
Des annonces prématurées, une confiance qui s’étiole
À noter que les deux vaccins concurrents sont complètement différents. Celui développé par Pfizer-BioNTech, baptisé BNT162b2, est un vaccin à ARN messager ; il incite les cellules à produire des protéines similaires à celles du SARS-CoV-2, afin de stimuler le système immunitaire, qui produira les anticorps adéquats. À ce jour, aucun vaccin de ce type n’a été approuvé et mis en circulation.
Le vaccin russe est quant à lui basé sur un vecteur adénoviral inactivé — une technique utilisée par plusieurs autres laboratoires, notamment par AstraZeneka et l’université d’Oxford. Il contient une forme d’adénovirus (un virus du rhume), modifié pour qu’il ne présente plus aucun risque infectieux ; il ne peut pas se répliquer. « Le vaccin russe a de particulier qu’il utilise deux vecteurs différents basés sur l’adénovirus humain, ce qui permet d’obtenir une réponse immunitaire plus forte et à plus long terme à la suite de la deuxième immunisation », ajoute le RDIF dans son communiqué. L’autre avantage de ce type de vaccin, contrairement aux vaccins à ARNm, est qu’il n’a pas besoin d’être stocké et transporté à des températures extrêmement basses, ce qui promet une logistique bien plus aisée.
Toute considération technique mise à part, certains spécialistes estiment que ces annonces d’efficacité n’ont tout simplement pas lieu d’être. Pour le Dr Hotez, ces laboratoires ne font que brûler les étapes pour prendre de l’avance, et ne respectent pas les règles habituelles : « La façon dont nous procédons est de soumettre d’abord le dossier aux régulateurs. Ceux-ci approuvent la demande d’autorisation et seulement alors vous continuez, et vous pouvez divulguer ces informations au public avec les données des essais cliniques prêtes à l’emploi », explique-t-il.
Martin McKee, professeur de santé publique européenne à la London School of Hygiene and Tropical Medicine, reconnaît lui aussi que 20 cas positifs constituent une bien faible base d’analyse. « Tout dépend du nombre de personnes incluses dans les essais et de la prévalence de l’infection dans les communautés où les essais ont lieu ». Le RDIF a déclaré que la Russie publierait le protocole d’essai clinique pour Sputnik V ce mois-ci et que la prochaine analyse intermédiaire portera sur 39 cas de COVID-19.
McKee a par ailleurs précisé que Pfizer avait initialement prévu une analyse intermédiaire sur seulement 32 cas positifs ! La Food and Drug Administration avait cependant déclaré que cela n’était pas suffisant, ce qui a mené le laboratoire à attendre 94 cas positifs (et Pfizer a annoncé cette semaine vouloir poursuivre l’essai jusqu’à ce que 164 cas positifs soient identifiés).
Aux yeux de la population, cette « course au vaccin » n’augure rien de bon. Les sondages montrent que peu de gens — notamment en France — envisagent de se faire vacciner si un vaccin devait arriver bientôt sur le marché. Eleanor Riley, professeure d’immunologie et de maladies infectieuses à l’Université d’Édimbourg, a exhorté tous les fabricants de vaccins à faire passer la qualité et la sécurité avant la vitesse. « Ce n’est pas une compétition ! », dit-elle. Bien que l’annonce du RDIF soit encourageante, elle apparaît bien vite (trop vite ?) après les résultats diffusés par Pfizer-BioNTech… L’experte ajoute qu’en agissant de cette manière, les laboratoires pourraient provoquer « une perte de confiance du public pour tous les vaccins, ce qui serait une catastrophe ».


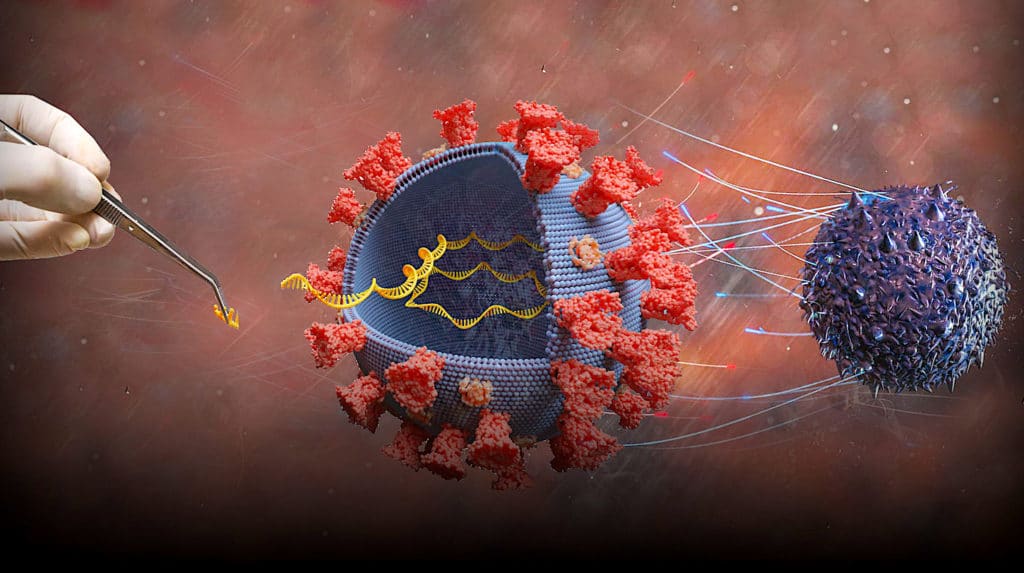 Vaccins à ARNm : comment fonctionnent-ils ? En quoi sont-ils innovants ?
Vaccins à ARNm : comment fonctionnent-ils ? En quoi sont-ils innovants ?