La greffe de cellules souches est utilisée pour remplacer ces dernières ou la moelle osseuse endommagée par une maladie ou certains traitements. Mais trouver un donneur compatible est toujours un obstacle de taille. Récemment, des chercheurs ont mis au point un système cardiaque artificiel simulant la circulation sanguine embryonnaire afin de produire, à la demande, des cellules souches hématopoïétiques. Cette avancée pourrait un jour éliminer le besoin de donneurs de sang ou de moelle osseuse, pour obtenir des cellules souches, et permettre des traitements médicaux ciblés pour de nombreuses maladies.
La greffe de cellules souches hématopoïétiques restaure l’hématopoïèse — processus de formation de toutes les lignées cellulaires sanguines — après les traitements agressifs de certains cancers et de certaines maladies génétiques, comme la drépanocytose. Cette greffe permet aux lignées sanguines de s’autorenouveler tout au long de la vie du receveur.
Néanmoins, trouver un donneur compatible s’avère extrêmement compliqué, et le plus souvent il s’agit donc d’un parent proche. En effet, le nombre de donneurs est restreint, le don de moelle osseuse étant peu fréquent. D’ailleurs, en France, plus de 2000 personnes sont en attente de greffe et seulement 50 banques mondiales dans le monde travaillent en collaboration. Sans compter que les donneurs potentiels sont encore plus limités lorsqu’il s’agit d’une ethnie particulière.
C’est pourquoi, créer in vitro des cellules souches, sans recours à des donneurs, est un projet ambitieux et crucial pour la médecine moderne. Récemment, une équipe de chercheurs de l’Université de Nouvelle-Galles du Sud (UNSW) a démontré comment un dispositif microfluidique qui imite le cœur embryonnaire peut produire des précurseurs de cellules souches sanguines, ce qui pourrait permettre de les concevoir à la demande. L’étude est publiée dans la revue Cell Reports.
Imiter le cœur d’un embryon
Depuis plusieurs années, les recherches se multiplient afin de produire artificiellement les cellules souches sanguines, mais sans succès. Le Dr Jingjing Li, auteur principal de la nouvelle étude, explique dans un communiqué : « Une partie du problème est que nous ne comprenons toujours pas pleinement tous les processus en cours dans le microenvironnement pendant le développement embryonnaire qui conduisent à la création de cellules souches sanguines vers le 32e jour ».
Concrètement, ici les chercheurs ont mis au point un système microfluidique de 3cm sur 3cm capable de pomper des cellules souches sanguines produites à partir d’une lignée de cellules souches embryonnaires, pour imiter le fonctionnement du cœur d’un embryon.
Le Dr Li déclare : « Nous avons créé un appareil imitant les battements du cœur et la circulation sanguine et un système d’agitation orbitale qui provoque une contrainte de cisaillement — ou friction — des cellules sanguines lorsqu’elles se déplacent dans l’appareil ».

Ce système a favorisé l’hématopoïèse, c’est-à-dire le développement de cellules souches sanguines précurseurs pouvant se différencier en divers composants sanguins — globules blancs, globules rouges, plaquettes et autres. De plus, l’appareil a créé les cellules tissulaires de l’environnement cardiaque embryonnaire, qui est crucial pour ce processus, avec la formation par exemple de la structure artérielle.
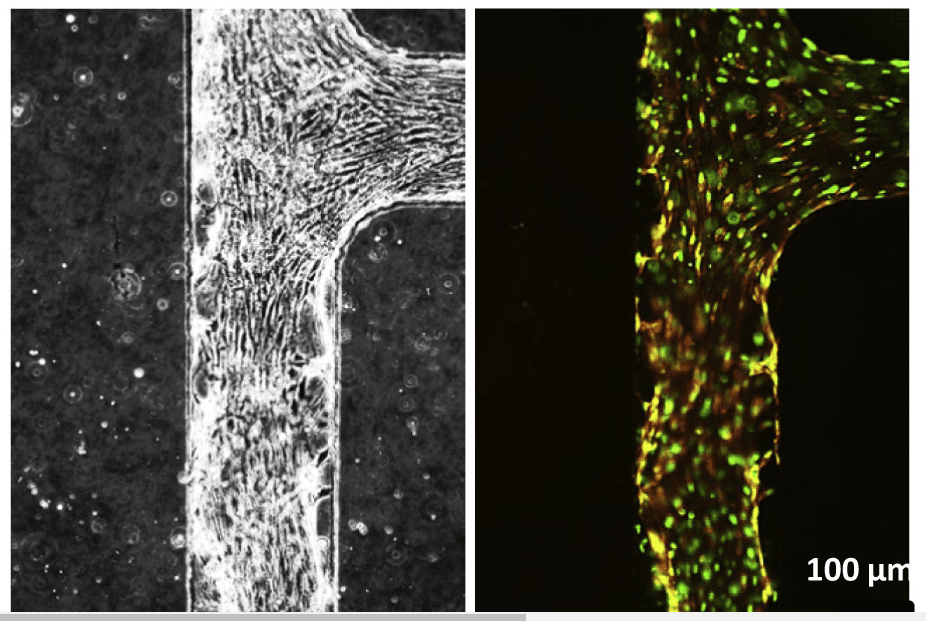
Robert Nordon, co-auteur de l’étude, explique : « Les cellules souches sanguines, lorsqu’elles se forment dans l’embryon, se forment dans la paroi du vaisseau principal appelé aorte. En sortant de l’aorte, elles intègrent la circulation, puis vont dans le foie et forment ce qu’on appelle l’hématopoïèse définitive, ou la formation définitive du sang ».
Concrètement, avec leur système cardiaque artificiel, les chercheurs sont parvenus à recréer ce processus aortique, avant l’intégration à la circulation sanguine générale (quand les cellules seront transférées au receveur dans le cas présent).
Nordon ajoute : « Ce que nous avons montré, c’est que nous pouvons générer une cellule qui peut former tous les types de cellules sanguines. Nous avons également montré qu’elle est très étroitement liée aux cellules qui tapissent l’aorte — nous savons donc que son origine est correcte — et qu’elle prolifère ».
Les chercheurs espèrent que leur découverte marquera une étape décisive vers la résolution des défis limitant les traitements médicaux régénératifs actuels : pénurie de cellules souches sanguines de donneurs, rejet des cellules de tissus de donneurs et problèmes éthiques entourant l’utilisation d’embryons de FIV pour obtenir les cellules souches. Le Dr Li a ajouté : « Nous travaillons à la fabrication à grande échelle de ces cellules à l’aide de bioréacteurs ».
Pourquoi leur système fonctionne-t-il ?
Outre le résultat extraordinaire qu’ils ont obtenu, certains éléments du processus sont restés flous ou imprécis durant l’étude. Mais une équipe parallèle de l’UNSW Medicine & Health, a peut-être trouvé réponse à ces questions. En effet, le professeur John Pimanda et le Dr Vashe Chandrakanthan ont mené leurs propres recherches sur la façon dont les cellules souches sanguines sont créées dans les embryons. L’étude est publiée dans la revue Nature Cell Biology.
Le professeur Pimanda déclare : « On savait déjà que ce processus se déroule dans les embryons de mammifères où les cellules endothéliales qui tapissent l’aorte [ce qu’ont démontré les chercheurs de la précédente étude] se transforment en cellules sanguines pendant l’hématopoïèse. Mais l’identité des cellules qui régulent ce processus était jusqu’à présent un mystère ».
Les auteurs ont démontré qu’il s’agit des cellules connues sous le nom de « cellules stromales PDGFRA+ dérivées de Mesp1 ». Elles résident sous l’aorte et n’entourent l’aorte que dans une fenêtre très étroite pendant le développement embryonnaire.
Le Dr Chandrakanthan a déclaré que connaître l’identité de ces cellules fournit aux chercheurs des indices sur la manière dont les cellules endothéliales adultes de mammifères pourraient être stimulées et dirigées afin qu’elles créent des cellules souches sanguines, ce qu’elles sont normalement incapables de faire. Il explique : « Nos recherches ont montré que lorsque les cellules endothéliales de l’embryon ou de l’adulte sont mélangées avec des ‘cellules stromales PDGFRA + dérivées de Mesp1’, elles commencent à fabriquer des cellules souches sanguines ».
Des recherches supplémentaires sont nécessaires afin d’envisager une démarche clinique et fournir un outil potentiel pour générer des cellules hématopoïétiques greffables, sans recours à un donneur compatible.
Le professeur Pimanda conclut : « L’utilisation de vos propres cellules pour générer des cellules souches sanguines pourrait éliminer le besoin de transfusions sanguines de donneurs ou de greffes de cellules souches. Le déverrouillage des mécanismes utilisés par la nature nous rapproche un peu plus de la réalisation de cet objectif ».


