Un nouveau vaccin thérapeutique ARNm personnalisé contre le mélanome, combiné à une immunothérapie, pourrait être disponible d’ici seulement deux ans. Lors d’un essai clinique de phase 3, le traitement combiné a réduit de 49% le risque de récidive — ce qui représente une percée majeure dans la recherche contre le cancer. La Food and Drug Administration américaine (FDA) et l’Agence Européenne des Médicaments (EMA) ont toutes deux placé le traitement sur une voie d’examen accélérée, en vue d’une approbation conditionnelle.
Le mélanome affecte chaque année près de 325 000 personnes dans le monde. Les stratégies de thérapie à base d’inhibiteurs de point de contrôle immunitaire ont considérablement amélioré le taux de survie au cours de la dernière décennie. Il s’agit d’anticorps thérapeutiques ciblant des signaux inhibiteurs entre les cellules tumorales (ou cellules présentatrices d’antigènes) et les lymphocytes T, dans le but d’activer l’immunité cellulaire T anti-tumorale. Cependant, le taux de survie des patients souffrant de mélanome métastatique reste faible.
Dans l’espoir d’améliorer le taux de survie des patients, les efforts de recherche se concentrent désormais sur les stratégies vaccinales. Il s’agit notamment de vaccins thérapeutiques, et non préventifs. Parmi les stratégies contre le mélanome figurent par exemple les vaccins non spécifiques à base de bacilles de Calmette-Guérin, ceux à base de cellules allogéniques (des cellules souches provenant d’un donneur) ou encore à base de peptides et de protéines tumorales. Cependant, malgré les nombreux essais, le seul vaccin approuvé par la FDA jusqu’ici, le sipuleucel-T, n’offre que des avantages mineurs en matière de survie.
Les laboratoires pharmaceutiques Merck et Moderna proposent une nouvelle approche vaccinale à ARNm (ARNm-4157/V940) combinée à l’immunothérapie : le pembrolizumab, commercialisé sous le nom de Keytruda, qui semble démontrer une incroyable efficacité par rapport aux précédentes stratégies. Les résultats de l’essai clinique sont disponibles sur la plateforme Applied Clinical Trials.
Un vaccin à ARNm combiné à une immunothérapie
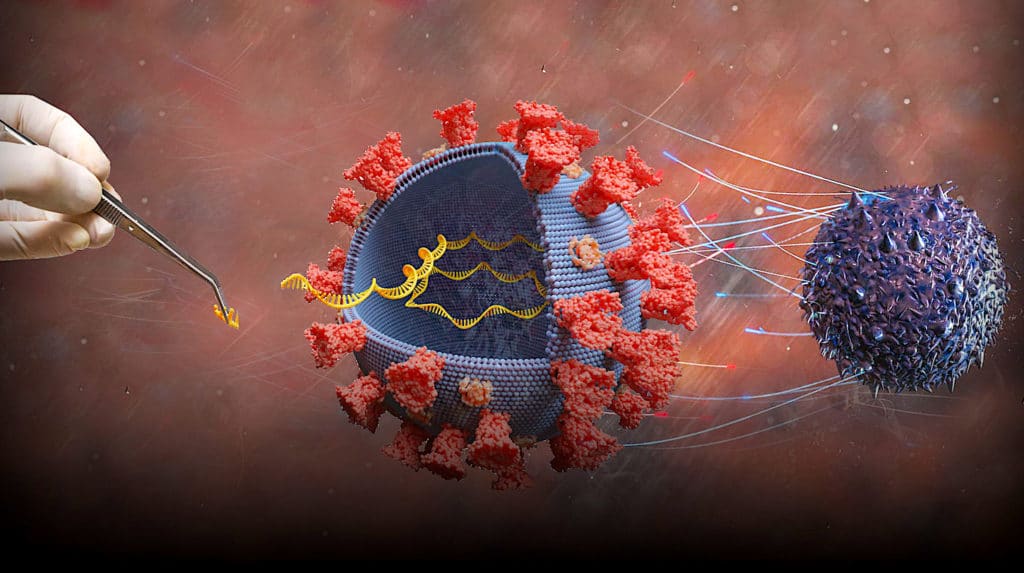
L’ARNm-4157/V940 est un ARNm personnalisé codant jusqu’à 34 néoantigènes (antigènes induits par des tumeurs et normalement non exprimés dans l’organisme) différents et spécifiques aux patients. Le processus de fabrication du vaccin consiste d’abord à séquencer le génome de la tumeur et des tissus sains environnants. Pour ce faire, Moderna utilise un algorithme spécialement développé pour comparer et identifier les mutations prometteuses à cibler pour éliminer la tumeur. L’ensemble du procédé, du prélèvement des échantillons jusqu’à la livraison de l’ARNm (encapsulé dans des nanoparticules lipidiques), durerait environ 6 semaines. À terme, le laboratoire prévoit de réduire ce délai à 30 jours.
De son côté, le Keytruda (développé par Merck) est une immunothérapie anti-récepteur de mort programmé-1 (PD-1). Plus précisément, il s’agit d’un anticorps monoclonal bloquant l’interaction entre le récepteur PD-1 et ses ligands PD-L1 et PDL-2. Cela permet d’activer les lymphocytes T de sorte à augmenter leur capacité à cibler les cellules tumorales.
Le traitement combiné comprend jusqu’à 9 doses intramusculaires du vaccin à ARNm (à raison d’une dose toutes les 3 semaines) et 9 perfusions intraveineuses de Keytruda. Les 157 patients éligibles aux essais devaient préalablement avoir bénéficié d’une résection chirurgicale complète de la tumeur, et ne pas récidiver pendant plusieurs semaines avant l’administration du traitement.
Résultat : la thérapie a réduit de 49% le risque de récidive sur une période de 3 ans, par rapport au Keytruda administré seul. Ce taux était de 44% lors de précédents essais suivis sur 2 ans. En outre, l’association des deux traitements a augmenté de 62% le taux de survie sans métastases à distance (se propageant dans d’autres organes), par rapport à la monothérapie Keytruda. « Nous avons une personne sur deux, par rapport au meilleur produit du marché, qui survit, ce qui est énorme en oncologie », a déclaré à Agence France-Presse Stephane Bancel, PDG de Moderna.
Par ailleurs, les laboratoires ont déclaré que les effets secondaires mineurs relevés étaient cohérents avec ceux antérieurement observés, c’est-à-dire qu’il n’y a pas eu d’aggravation. Ces effets indésirables incluaient notamment la fatigue, couramment observée pour la plupart des vaccins à ARNm (dans 60% des cas), une douleur au site d’injection (56,7%) et un état fiévreux (49 %).
En vue de ces résultats, la thérapie pourrait être disponible dans certains pays d’ici 2025, sous approbation accélérée par la FDA et l’EMA. Parallèlement à la demande d’approbation, les laboratoires prévoient de lancer un troisième essai, plus vaste (portant sur un millier de personnes), d’ici 2024. D’autre part, une nouvelle usine est en ce moment en construction par Moderna en vue d’appuyer les futurs approvisionnements à grande échelle et afin de se conformer aux exigences de la FDA et de l’EMA. L’entreprise a par ailleurs annoncé les essais de phase 3 pour un vaccin à ARNm contre le cancer de poumon, ainsi que pour d’autres types de tumeurs.