Les autres candidats
Hormis le silicium, d’autres atomes ont été proposés pour des biochimies exotiques. C’est le cas de l’azote, du phosphore, du chlore et du soufre.
La combinaison phosphore-azote (P-N) est particulièrement intéressante dans des environnements où la biomasse ne reposerait pas sur le cycle du carbone mais sur celui des oxydes d’azote.
Une atmosphère composée majoritairement d’ammoniac permettrait aux organismes pourvus d’une biochimie P-N de procéder à l’oxydo-réduction de l’ammoniac pour produire de l’hydrogène et des composés azotés. Néanmoins, un cycle des oxydes d’azote demeure peu probable du fait de son bilan énergétique global négatif.
Le soufre est envisagé comme remplaçant de l’oxygène dans le circuit métabolique. Un tel mécanisme est utilisé par plusieurs bactéries extrêmophiles utilisant le soufre à la place de l’oxygène par réduction du premier en sulfure d’hydrogène.
Les bactéries phototrophes sulfo-oxydantes comme les bactéries vertes sulfureuses sont des bactéries photosynthétiques qui ont remplacé le cycle du carbone par le cycle du soufre. Des traces de tels micro-organismes ont été retrouvées dans des sédiments datant de 3.5 milliards d’années.
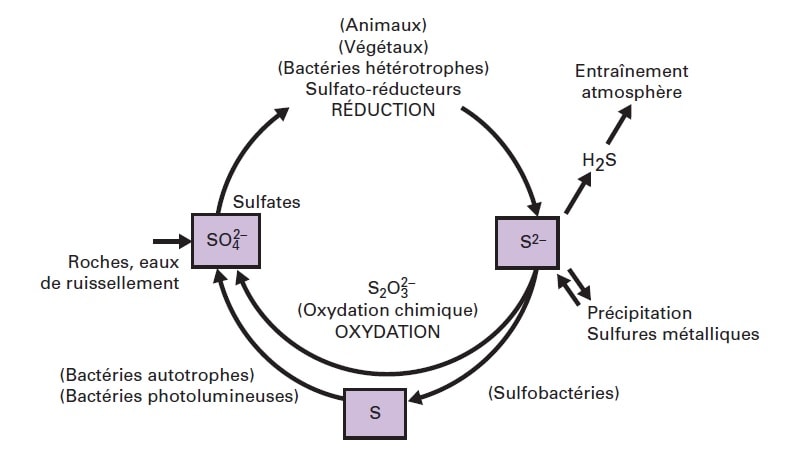
Le chlore est suggéré lui aussi comme un substitut à l’oxygène pour différentes biochimies dont la biochimie carbonée.
Toutefois, la constitution de composés organochlorés stables s’avère extrêmement complexe au regard de la grande réactivité du chlore en milieu hydrogéné. C’est cette même réactivité qui conduirait le chlore à dissoudre tout composé hydrogéné en chlorure d’hydrogène, rendant fortement instable toute structure moléculaire, y compris les plus neutres. En outre, la présence cosmique du chlore est très faible.
L’eau : le solvant unique de la vie ?
Au même titre que le carbone, l’eau possède de nombreuses caractéristiques qui font de cette molécule l’unique solvant utilisé par la vie terrestre. Que ce soit sa propriété amphotère lui permettant d’intervenir dans plusieurs réactions d’oxydo-réduction biomoléculaires, sa très grande capacité de dissolution, ou les valeurs de ses points de fusion et d’ébullition à pression normale, l’eau est ubiquitaire dans la biochimie terrestre. Toutefois, là aussi, les scientifiques ont proposé quelques solvants alternatifs.
Tout comme l’eau, l’ammoniac permet le déroulement de plusieurs réactions chimiques de biosynthèse et possède un pouvoir de dissolution quasi-identique à l’eau concernant les biomolécules et les protéines.
En outre, l’ammoniac dispose d’une bonne capacité thermique, lui conférant une interface thermique efficace pour la régulation des températures. Malgré sa réactivité avec l’oxygène (l’ammoniac s’oxyde rapidement), il se montre stable dans des milieux fortement hydrogénés.

L’inconvénient de l’ammoniac repose essentiellement dans ses points de fusion et d’ébullition, respectivement −78 °C et −33 °C à pression normale. Ces basses températures impactent considérablement la cinétique des réactions biochimiques en réduisant leur vitesse. Pour conserver son état liquide à température ambiante, l’ammoniac devrait être plongé dans un milieu à très haute pression (environ 60 atmosphères). En outre, l’instabilité de ses liaisons hydrogène et sa faible tension superficielle constituent également des obstacles.
Le fluorure d’hydrogène est également suggéré comme alternative possible à l’eau. Sa polarité lui confère un pouvoir de dissolution semblable à l’eau et à l’ammoniac. Il peut en outre former des complexes multi-moléculaires par l’établissement de plusieurs liaisons hydrogènes stables. Il dispose enfin d’une gamme de température pour l’état liquide d’environ 100 °C.
Une biochimie inversée ?
La chiralité d’une molécule est la propriété de cette dernière d’exister sous deux formes possibles. Dans le cas des biomolécules, l’on distingue deux énantiomères (formes non superposables) : lévogyre « L » (dévie la lumière vers la gauche) et dextrogyre « D » (dévie la lumière vers la droite).
Depuis le 19ème siècle, notamment grâce aux travaux de Pasteur, les scientifiques savent que, dans la biochimie terrestre, tous les acides aminés sont lévogyres et tous les glucides (sucres) sont dextrogyres.
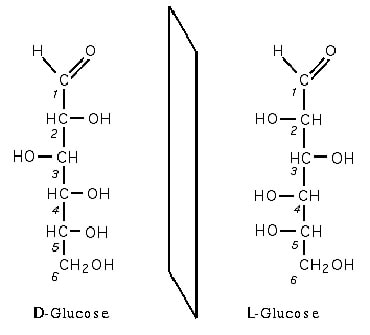


Les acides aminés D et les glucides L possèdent les mêmes propriétés chimiques que leurs analogues. Les chaînes polypeptidiques constituées d’acides aminés dextrogyres sont toutes aussi stables et aptes à former des protéines que celles constituées d’acides aminés lévogyres. Cependant, une chaîne composée d’un mélange des deux serait fortement instable.
Ainsi, une biochimie extraterrestre inversée, ou impliquant d’autres acides aminés que les 20 acides aminés protéinogènes nécessaires à la vie terrestre, pourrait être possible.


