Des chercheurs ont identifié pour la première fois un composé aidant à restaurer intégralement le contrôle moteur après un accident vasculaire cérébral (AVC), une capacité que les patients retrouvent très rarement, même après une rééducation intensive. En d’autres termes, ce composé reproduit certains effets de la rééducation sans nécessiter une thérapie physique longue et éprouvante. À terme, ces travaux pourraient ouvrir la voie à un traitement universel efficace pour les victimes d’AVC.
L’AVC demeure la première cause d’invalidité chez l’adulte à l’échelle mondiale, les fonctions motrices étant rarement récupérées dans leur intégralité. On estime que 70 à 80 % des survivants d’un AVC présentent une altération du fonctionnement des membres supérieurs, et une grande proportion d’entre eux ne retrouve pas un usage fonctionnel complet du bras le plus touché.
Contrairement à d’autres pathologies invalidantes, telles que les cancers, les maladies auto-immunes ou cardiovasculaires, il n’existe à ce jour aucun traitement médicamenteux efficace pour la récupération post-AVC. Si les techniques de rééducation — ou de neuroréadaptation — peuvent améliorer les capacités motrices, leur efficacité reste inégale, du fait de multiples facteurs : inaccessibilité des soins, intensité des protocoles, sévérité de l’AVC, etc. La récupération varie donc considérablement d’un patient à l’autre.
« Les effets réels de la rééducation après un AVC sont limités, car la plupart des patients ne parviennent pas à maintenir l’intensité requise pour une récupération optimale. En outre, la prise en charge des AVC diffère de la plupart des spécialités médicales, dans lesquelles des traitements existent, comme en cardiologie, infectiologie ou oncologie », explique S. Thomas Carmichael, professeur et président du département de neurologie de l’Université de Californie à Los Angeles (UCLA).
Dans une étude récente, le chercheur et son équipe ont mis au jour un mécanisme moléculaire qui pourrait enfin permettre de traiter par voie pharmacologique les déficits moteurs post-AVC. « Ces travaux s’inscrivent dans une approche de plus en plus fondée sur la médecine moléculaire », précise-t-il.
Une désorganisation neuronale au-delà de la zone lésée
Des recherches antérieures ont montré que la récupération fonctionnelle après un AVC repose sur des modifications des réseaux neuronaux excitateurs et inhibiteurs, lesquelles influencent la plasticité synaptique. En particulier, la plasticité neuronale post-AVC semble dépendre d’un équilibre délicat entre ces signaux. Plus les signaux excitateurs dominent, plus les chances de récupération sont importantes.
Mais cette interprétation apparaît aujourd’hui trop simpliste : les connexions entre neurones excitateurs et inhibiteurs obéissent à une complexité bien plus grande. Pour dépasser cette limite, les chercheurs ont exploré au niveau moléculaire les mécanismes par lesquels la neuroréadaptation améliore la fonction cérébrale après un AVC. « Notre objectif est de développer un médicament qui reproduise les effets de la rééducation chez les patients victimes d’un AVC », précise Carmichael.
L’équipe a mené ses travaux à la fois sur des modèles murins et sur des patients humains. Les analyses ont révélé une altération des connexions neuronales dans des régions cérébrales éloignées du site initial de l’AVC. Les neurones affectés dans ces zones ne parvenaient plus à établir des connexions fonctionnelles, compromettant des capacités fondamentales comme la motricité des bras ou la marche.
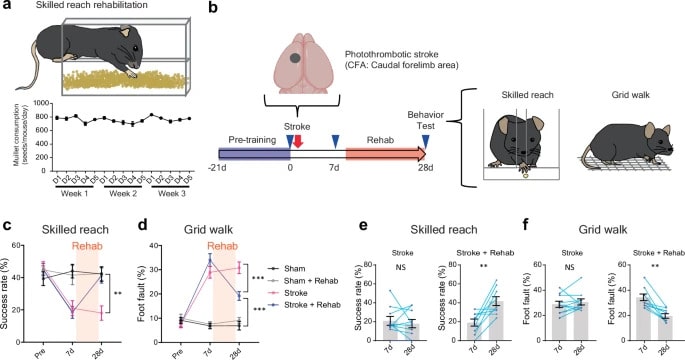


Les chercheurs ont observé que ces pertes de connexions concernaient en particulier les neurones dits à parvalbumine, essentiels à la coordination des fonctions motrices. Ces cellules nerveuses orchestrent également les oscillations gamma, qui synchronisent l’activité des réseaux neuronaux. L’AVC perturbe ces oscillations, tandis que la rééducation permet de les restaurer, tant chez la souris que chez l’humain.
La phase suivante des travaux visait à identifier des composés capables d’induire ces oscillations gamma. « Nos résultats définissent les circuits cérébraux activés durant la rééducation et ouvrent la voie à une sélection raisonnée de molécules pour initier une thérapie de rééducation moléculaire », peut-on lire dans l’étude. Deux composés candidats ont été identifiés, ciblant spécifiquement l’excitation des neurones à parvalbumine. L’un d’eux, la DDL-920, a permis une récupération significative de la motricité chez les souris traitées.
Des recherches complémentaires seront toutefois indispensables pour élucider en profondeur les mécanismes à l’œuvre dans cette récupération post-AVC, et pour tester l’efficacité et l’innocuité du composé chez l’être humain. Mais ces résultats prometteurs pourraient, à terme, déboucher sur un traitement venant compléter les approches de rééducation classiques, voire les alléger dans certains cas.