Alors que le génie génétique avance à grands pas avec des outils d’édition tels que CRISPR-Cas9, dont la dernière version en date, plus précise que jamais, pourrait permettre de guérir toute maladie génétique dans un avenir proche, d’autres méthodes de modulation génique sont à l’étude. Récemment, des chercheurs ont utilisé avec succès des bactéries génétiquement modifiées pour moduler l’expression des gènes au sein même des cellules d’un hôte animal, afin d’entamer toutes sortes de processus de « guérison ». Le but ultime étant de guérir certaines maladies ou de réparer des tissus endommagés comme jamais auparavant.
Pour le moment, les chercheurs n’ont effectué des essais que sur des souris. Dans une nouvelle étude, ils ont montré que ces bactéries modifiées, une fois qu’elles pénètrent dans les cellules immunitaires des animaux, libèrent comme prévu des protéines pour modifier le comportement de ces cellules.
Dans l’idéal, ces bactéries sont censées continuer à vivre en harmonie avec l’hôte afin de continuer à moduler l’expression des gènes ciblés. L’étude, qui détaille les méthodes permettant de parvenir avec succès à ce premier résultat encourageant, constitue une étape clé pour le développement « d’endosymbiontes artificiels » (EES, pour engineered endosymbionts en anglais).
Les endosymbiontes sont des organismes qui vivent à l’intérieur d’une autre cellule ou d’un autre organisme, l’association formée étant « l’endosymbiose ». Ainsi, ils pourraient théoriquement effectuer toutes sortes de tâches de modification ou de réparation, allant de la régénération des tissus endommagés jusqu’au traitement des cancers.
L’idée de créer des endosymbiontes (ou endosymbiotes) artificiels était autrefois considérée comme fantaisiste, mais au vu des nombreux progrès réalisés ces dernières années, notamment dans notre capacité à concevoir des organismes, elle commence à être considérée comme réalisable. Et c’est ce que cherchent à produire, à commencer par cette nouvelle étude, des scientifiques de la Michigan State University. Les détails ont été publiés sur le serveur de préimpression bioRxiv.
Endosymbionte artificiel, le cheval de Troie du génie génétique
« C’est une vision à long terme », déclare Christopher Contag de la Michigan State University. Plusieurs autres groupes développent également des endosymbiontes artificiels qui, selon eux, pourraient nous permettre de rendre les cultures et les animaux d’élevage plus productifs et de traiter les affections liées au vieillissement.
« C’est l’une des choses les plus importantes dans un avenir très proche », affirme-t-il. « J’ai constaté un énorme intérêt au cours des cinq dernières années environ ». Nous savons que la plupart des organismes dépendent des microbes (bactéries ou virus) qui vivent sur ou dans eux (le microbiome), mais parfois la relation est encore plus intime. Certaines bactéries vivent à l’intérieur des cellules des plantes ou des animaux dans une relation mutuellement bénéfique appelée endosymbiose.
Les endosymbiontes peuvent conférer aux organismes des capacités vitales pour leur survie. Par exemple, les structures productrices d’énergie de toutes les cellules animales et végétales sont issues de bactéries endosymbiotiques, tout comme les structures photosynthétiques de toutes les cellules végétales.
Pour créer un nouvel endosymbionte à partir de rien, l’équipe de Contag a commencé par la bactérie Bacillus subtilis, que l’on trouve notamment dans nos intestins. « Il s’agit d’une bactérie normale du microbiote », explique Cody Madsen, membre de l’équipe, également à la Michigan State University.
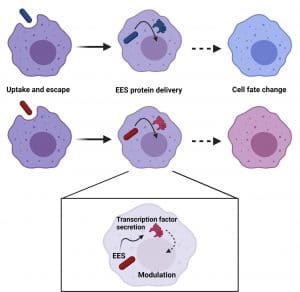
Les chercheurs l’ont modifiée pour qu’elle produise des protéines de mammifères qui modifient l’activité des gènes et contrôlent ainsi l’activité des cellules. Pour faire pénétrer la bactérie dans les cellules de souris, l’équipe s’est appuyée sur le fait que certaines cellules animales peuvent engloutir des bactéries par un processus appelé phagocytose. Normalement, les bactéries englouties restent piégées dans des sacs membranaires où elles sont digérées. Mais la souche de B. subtilis modifiée sécrète une protéine qui lui permet de s’échapper de ces sacs.
Les chercheurs ont ajouté la bactérie modifiée à des cellules immunitaires de souris, appelées macrophages, qui se développaient dans une boîte de Petri. Ils ont ainsi réussi à faire pénétrer la bactérie dans 99% des cellules. Ils ont également montré que les protéines de mammifères que la bactérie avait été conçue pour produire, modifiaient le comportement des macrophages.
Prochaine étape : faire en sorte que les bactéries vivent en symbiose avec leurs hôtes
Ce que l’équipe doit encore réussir à obtenir, c’est que les bactéries vivent en harmonie avec leurs nouveaux hôtes. Après deux jours, 10% des macrophages étaient tués par les bactéries qu’ils contenaient, qui se divisaient et se reproduisaient trop rapidement.
Pour remédier à cela, Madsen veut ajouter un circuit génétique qui garantira que la bactérie ne se divise que lorsque la cellule hôte se divise. L’équipe prévoit également de concevoir les bactéries de manière à pouvoir les contrôler une fois qu’elles sont à l’intérieur d’un animal, en les faisant réagir à des produits chimiques ou à des champs magnétiques spécifiques. L’avantage de l’utilisation du magnétisme est qu’il permet un contrôle localisé.
« On pourrait transformer les cellules qui contiennent ces endosymbiontes en cellules souches, puis actionner un autre interrupteur et transformer cette cellule souche en un autre type de cellule », explique Contag. De tels interrupteurs pourraient également être utilisés pour tuer la bactérie si nécessaire, explique Madsen.
Selon Bogumil Karas, de l’université de Western Ontario au Canada, il est étonnant que l’équipe ait réussi à introduire la bactérie dans une telle proportion de cellules. Mais il sera selon lui beaucoup plus difficile d’y parvenir dans l’organisme, et dans d’autres types de cellules, et il est évidemment crucial d’obtenir une survie à long terme.
« Je ne suis pas convaincu que les endosymbiontes artificiels offrent nécessairement des avantages par rapport à des approches moins complexes », déclare John Rasko, expert en cellules souches à l’université de Sydney. « Les obstacles réglementaires et les défis éthiques sont probablement encore plus importants que les obstacles techniques ».
Des applications potentielles en agriculture
Il existe de nombreuses autres façons de contrôler l’activité des gènes dans les cellules de mammifères, explique Huseyin Sumer, de l’université de technologie de Swinburne, en Australie. « L’application la plus immédiate [des endosymbiontes artificiels] pourrait être dans l’agriculture », dit-il.
Par exemple, des plantes comme les haricots n’ont pas besoin d’engrais azotés car elles peuvent capter l’azote directement dans l’atmosphère grâce à des bactéries qui se développent sur leurs racines. L’équipe de Karas tente de donner cette capacité à d’autres cultures en transformant les bactéries fixatrices d’azote en endosymbiontes.
Cela pourrait avoir d’énormes avantages, car les engrais azotés sont une source importante de gaz à effet de serre ainsi qu’un polluant majeur des rivières et des mers. En principe, les endosymbiontes artificiels pourraient être utilisés pour conférer aux animaux des capacités extraordinaires. Sumer explique que son équipe avait commencé à mener des expériences pour voir si les cellules de mammifères étaient capables de faire de la photosynthèse, avant que la pandémie n’interrompe les travaux.