Si la grande majorité des personnes infectées par le SARS-CoV-2 présentent aujourd’hui des symptômes légers à modérés, voire aucun symptôme, le virus continue de faire des victimes en se propageant au plus profond des tissus pulmonaires. Il apparaît cependant que les personnes souffrant d’asthme allergique sont moins susceptibles de développer des formes sévères de COVID-19 que d’autres souffrant d’affections pulmonaires apparentées. Des chercheurs américains révèlent dans une nouvelle étude le mécanisme sous-jacent de cet effet protecteur inattendu.
L’asthme est une maladie chronique caractérisée par une inflammation des voies respiratoires ; ces dernières se rétrécissent et produisent plus de mucus, ce qui provoque une importante gêne respiratoire (la respiration devient « sifflante »). L’asthme allergique est déclenché par des allergènes, tels que les moisissures, le pollen ou les squames d’animaux. L’exercice physique intense, la pollution de l’air (particules fines) et d’autres substances irritantes peuvent quant à eux déclencher d’autres formes d’asthme.
Dès le début de la pandémie, les troubles pulmonaires, en particulier la BPCO (Bronchopneumopathie Chronique Obstructive) ou l’emphysème, ainsi que l’asthme non allergique, sont apparus comme des facteurs aggravants de COVID-19. Mais contre toute attente, les patients souffrant d’asthme allergique développaient moins souvent une forme sévère de COVID-19 par rapport à la population générale. Les chercheurs ont enfin trouvé l’explication à ce phénomène : tout repose sur une protéine appelée interleukine-13 (ou IL-13).
Une surproduction de mucus capable de piéger les agents pathogènes
« Nous savions qu’il devait y avoir une raison biomécanique pour laquelle les personnes souffrant d’asthme allergique semblaient plus protégées contre la maladie grave », a déclaré Camille Ehre, physiopathologiste à la faculté de médecine de l’Université de Caroline du Nord et auteure principale de l’étude. Au cours de leurs recherches, Ehre et son équipe ont découvert plusieurs changements cellulaires majeurs impliquant l’IL-13, suggérant que cette cytokine jouait un rôle contre l’infection par le SARS-CoV-2.
L’IL-13 est une cytokine sécrétée principalement par des cellules T activées. Elle contribue notamment à défendre l’organisme contre les infections parasitaires en induisant certaines modifications physiologiques qui rendent l’environnement hostile aux parasites. Par exemple, en cas d’infection par des vers, le corps réagit en produisant du mucus et en resserrant les voies respiratoires de manière à « emprisonner » les vers jusqu’à ce que d’autres cellules immunitaires les détruisent. Or, dans le cas de l’asthme allergique, l’organisme réagit de même, car il prend l’allergène (pollens, poils d’animaux) pour des parasites.
Pour comprendre dans quelle mesure l’IL-13 protège les personnes asthmatiques contre le SARS-CoV-2, les chercheurs ont cultivé en laboratoire des cellules provenant de la muqueuse des voies respiratoires, dont certaines ont été traitées avec l’IL-13 (pour simuler un asthme allergique). L’ensemble des cellules ont ensuite été infectées par le SARS-CoV-2. Dans un premier temps, il était question de saisir comment le virus se répandait dans des cellules pulmonaires saines et non traitées par l’IL-13.
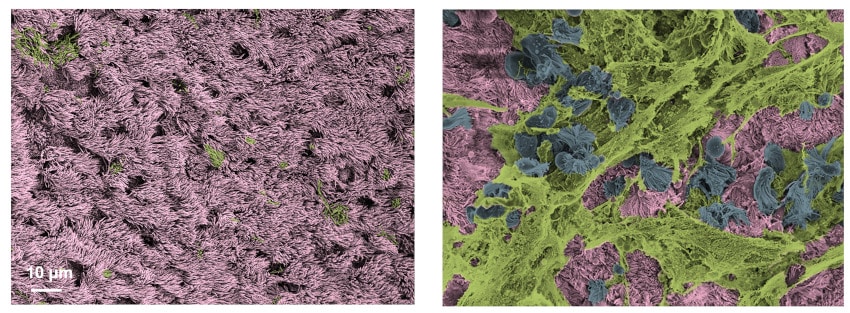
Grâce à l’analyse génétique des cellules infectées, les chercheurs ont découvert que l’expression de la protéine ACE2 — que le virus utilise pour se fixer sur les cellules et y pénétrer — régissait les types de cellules infectées et leur charge virale : ainsi, les cellules ciliées — des cellules chargées de déplacer la couche de mucus hors des poumons, via le battement de leurs cils — étaient infectées par le virus, tandis que les cellules productrices de mucus (les cellules caliciformes) étaient rarement infectées.
De ce fait, l’équipe a observé un important exode du virus à partir des cellules ciliées infectées. Elle a également noté d’importants changements cellulaires (dus à l’infection) menant à l’expulsion des cellules ciliées infectées de la surface des voies respiratoires. Résultats : non seulement le virus dispose d’un réservoir viral très étendu favorisant sa transmission, mais l’excrétion favorise également le déplacement des cellules infectées vers les tissus pulmonaires plus profonds.
Un triple effet protecteur contre l’infection au SARS-CoV-2
Restait à déterminer le rôle de l’IL-13 dans ce processus en observant le comportement des cellules pulmonaires traitées avec cette cytokine. Les chercheurs ont immédiatement remarqué que beaucoup moins de cellules infectées étaient expulsées en surface, du fait que l’IL-13 réduisait les battements des cellules ciliées. Les cellules non traitées avaient expulsé environ 700 cellules mourantes quatre jours après l’infection, tandis que seulement une centaine ont été expulsées dans le cas des cellules traitées.



Tout comme lorsqu’elle défend l’organisme contre un parasite, l’IL-13 a vraisemblablement stimulé les cellules des voies respiratoires de manière à ce qu’elles produisent un mucus plus collant, pouvant piéger le virus avant qu’il ne se répande dans d’autres cellules. La production de ce mucus était bien plus soutenue dans les cellules traitées que dans les cellules non traitées. Mais ce n’est pas tout ! L’équipe a également découvert que l’IL-13 diminuait l’expression de l’ACE2 ; il est par conséquent beaucoup plus difficile pour le virus de trouver le moyen d’entrer dans les cellules.
Enfin, l’IL-13 a montré d’autres avantages face à l’infection : les chercheurs ont découvert qu’elle avait la capacité de limiter la réplication virale au sein des cellules en réduisant l’activité de certains gènes impliqués dans la fabrication des protéines. En parallèle, l’activité d’autres gènes semble accrue sous l’action de l’IL-13, en particulier celle des gènes impliqués dans la synthèse de sulfate de kératane — une grosse protéine que l’on trouve dans la cornée, le cartilage et dans d’autres tissus conjonctifs, qui agit comme une couche protectrice. Ehre et ses collègues ont découvert que les cellules traitées à l’IL-13 étaient recouvertes d’une épaisse couche de sulfate de kératane, agissant comme un bouclier protecteur contre l’infection.
« L’excrétion virale et cellulaire intense causée par l’infection par le SARS-CoV-2 a été atténuée par l’IL-13, qui a affecté l’entrée, la réplication et la propagation du virus », concluent les chercheurs. L’IL-13 est donc associée à trois avantages majeurs contre le SARS-CoV-2, mais l’équipe n’a pas encore déterminé lequel de ces mécanismes était le plus important face à l’infection. Étant donné qu’elle favorise l’inflammation et la production de mucus, cette cytokine ne peut évidemment pas être utilisée elle-même comme traitement, mais mieux comprendre son mode d’action pourrait aider à développer un nouveau médicament contre les formes graves de COVID-19.


