L’asymétrie est présente partout dans la nature, y compris au niveau atomique et moléculaire. Pouvoir manipuler la chiralité des molécules ouvrirait la voie à de nombreuses avancées en biochimie et pharmacologie. En utilisant un faisceau de lumière, des chimistes ont découvert comment changer la chiralité des molécules, et plus précisément comment passer d’un énantiomère à un autre.
Pour revenir à la chimie de base, une molécule est une structure chimique composée de deux atomes ou plus. Par exemple, l’eau est une molécule composée de deux atomes d’hydrogène et d’un atome d’oxygène, le dioxyde de carbone est composé de deux atomes d’oxygène et d’un atome de carbone, etc.
Beaucoup de molécules sont symétriques, mais pas toutes. Et certaines de ces molécules asymétriques sont des images inverses exactes les unes des autres, qui ne peuvent pas être superposées ; c’est la chiralité moléculaire asymétrique. Ces molécules chirales peuvent être des molécules S gauches (de « sinister », mot latin pour « gauche »), ou des molécules R droites (de « rectus », mot latin pour « droit »).
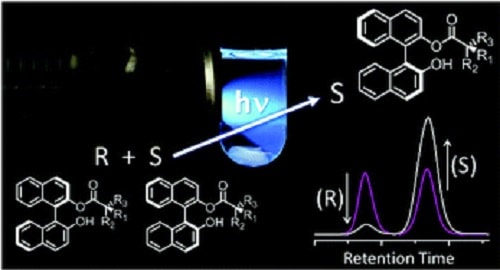
Les scientifiques ont maintenant compris comment transformer une molécule S en molécule R en utilisant une technique appelée transfert de protons à l’état excité. Les résultats de l’expérience ont été publiés dans la revue Chemical Communications.
Le chiralité peut avoir une importance capitale, notamment en pharmacologie. La catastrophe de la thalidomide en est un exemple frappant. Un nouveau médicament appelé thalidomide (C13H10N2O4) a été mis sur le marché en 1957 en tant que sédatif sans danger, et pour traiter les nausées matinales des femmes enceintes. Il a été vendu dans le monde entier.
Sur le même sujet : Des molécules ont été contrôlées individuellement pendant quelques femtosecondes
Cependant, lorsqu’un nombre croissant de bébés naissent avec des anomalies congénitales à la suite de l’introduction de ce médicament, un pédiatre établit la connexion en 1960, et la thalidomide est retirée des pharmacies. Environ 120’000 grossesses ont été touchées — la plupart se sont soldées par une fausse couche — mais 10’000 bébés sont nés avec des malformations.
En fin de compte, la (R)-thalidomide était parfaitement sans danger. C’était la (S)-thalidomide qui était tératogène, produisant des défauts de développement chez les embryons. Bien que ce ne soit pas le cas pour tous les médicaments, la chiralité peut affecter le développement du médicament, car les molécules chirales peuvent se lier différemment aux récepteurs cibles. Les chimistes ont tenu compte de cette situation après la catastrophe de la thalidomide.



C’est pourquoi le fait de pouvoir changer de chiralité serait un outil puissant pour produire des molécules thérapeutiques qui ont toutes la même nature. Pour cette recherche, l’équipe a expérimenté une molécule organique appelée BINOL, très utilisée en chimie organique de synthèse pour le développement d’une vaste gamme de réactions catalytiques asymétriques. L’efficacité de ces réactions repose sur la pureté du BINOL, droit ou gauche.
L’équipe a fixé un acide aminé gauche au BINOL et l’a exposé à un faisceau de lumière noire. Après 60 minutes, ce qui avait été un mélange 50-50 de (R)- et de (S)-BINOL avait 31% de (R)-BINOL en plus que de (S)-BINOL. Évidemment, cela signifie que l’échantillon n’était pas purement du (R) -BINOL, mais l’expérience visait à prouver le concept pour déterminer si la technique pouvait réellement fonctionner. Maintenant que cela a été démontré, l’équipe travaillera à l’affiner, dans l’espoir de produire un échantillon plus pur.