Anthony Fauci, immunologue et directeur de l’Institut américain des allergies et maladies infectieuses (le NIAID), vient de déclarer qu’il serait possible de mettre rapidement fin aux essais cliniques de vaccins en cours si l’un d’eux s’avérait extrêmement concluant.
Trois essais cliniques majeurs, impliquant des milliers de volontaires, sont en cours aux États-Unis. Ils devraient se terminer d’ici la fin de l’année. Mais si les résultats intermédiaires s’avèrent très positifs (ou au contraire, négatifs), Fauci affirme qu’un conseil indépendant a le pouvoir d’y mettre fin immédiatement. « Une obligation morale » selon l’expert, afin de mettre le vaccin à disposition de tous le plus rapidement possible.
Des études surveillées de près
Expert en maladies infectieuses, Fauci est aussi le conseiller officiel de la Maison-Blanche sur la crise du coronavirus. Pourquoi une telle déclaration ? Parce que les élections américaines approchent à grands pas… Et certains experts craignent que l’administration Trump ne mette la pression aux régulateurs fédéraux et aux équipes scientifiques pour accélérer la mise au point et l’approbation d’un vaccin, dans le seul but de redorer le blason de l’actuel président.
Fauci a donc jugé bon d’intervenir pendant cette période délicate, en déclarant qu’il faisait pleinement confiance aux membres du DSMB (le Data Safety and Monitoring Board), un groupe indépendant du gouvernement, chargé de vérifier les résultats intermédiaires obtenus pendant les essais cliniques. Ce comité de surveillance, exempt — en théorie — de toute influence politique, est composé d’experts en vaccinologie et en biostatistique.
Ainsi, ses membres examinent régulièrement les données des essais pour déterminer si oui ou non il est utile, et surtout éthique, de continuer à recruter des volontaires (qui reçoivent, au hasard, le vaccin expérimental ou un placebo). Fauci demeure convaincu que le feu vert du comité ne sera donné que s’il existe de très bonnes preuves que le vaccin est sûr et efficace.
Trois vaccins anti-COVID sont testés en ce moment à grande échelle aux États-Unis. Les deux premiers essais — l’un mené par le laboratoire Moderna et les National Institutes of Health, l’autre dirigé par Pfizer et BioNTech — ont débuté fin juillet. AstraZeneca, qui a d’ores et déjà réalisé des essais cliniques en Grande-Bretagne, au Brésil et en Afrique du Sud, a lancé un essai sur le territoire américain cette semaine. Tous les trois visent à impliquer pas moins de 30’000 volontaires ; les deux premiers essais en ont déjà recruté la moitié.
Selon le Dr Robert Redfield, directeur des Centers for Disease Control and Prevention, à cette échelle, 150 à 175 infections suffiront à déterminer si oui ou non le vaccin est réellement efficace : « Cela peut être surprenant, mais le nombre d’événements qui doivent se produire est relativement faible ». Bien entendu, si l’essai présente des problèmes avérés de sécurité (effets indésirables…), le conseil de sécurité peut décider de le stopper.
À ce jour, seul le DSMB a accès aux données des différents essais cliniques. La date de disponibilité des résultats n’est pas connue, mais toutes les données utilisées pour prendre une décision seront rendues publiques le moment venu.
Une confiance déjà fragile
Pour qu’un essai puisse prendre fin, il doit répondre à une liste de critères très précise, établie par le conseil de surveillance. À noter enfin que même si le conseil recommande l’arrêt d’un essai, la décision finale revient à l’équipe de scientifiques qui dirige l’étude. Si un laboratoire décide de continuer ses essais malgré les recommandations, il a la possibilité de demander une autorisation d’utilisation d’urgence à la Food and Drug Administration (FDA), ou bien poursuivre le processus standard d’approbation des médicaments, ce qui nécessitera bien plus de temps et de preuves.
Mais la FDA a été vivement critiquée ces dernières semaines. Plusieurs scientifiques, dont le Dr Eric Topol, vice-président exécutif de la recherche chez Scripps Research à San Diego, et expert sur l’utilisation des données de recherche médicale, accusent Stephen Hahn — à la tête de la FDA depuis fin 2019 — de céder à la pression politique de l’administration Trump, qui aurait poussé l’agence à approuver plus rapidement les traitements contre la COVID.
Comme le souligne Topol, tirer des conclusions d’un essai clinique n’est pas si simple : en stoppant l’expérimentation de façon prématurée, l’efficacité du vaccin pourrait être exagérée. L’expert rappelle en effet que les preuves « moins positives » n’apparaissent généralement que plus tard. Paul Offit, pédiatre américain spécialisé dans les maladies infectieuses (et co-inventeur d’un vaccin contre le rotavirus), confirme ces propos : un essai abrégé pourrait empêcher la détection d’effets secondaires importants, qui ne commenceraient à se déclarer qu’après que des millions de personnes ont été vaccinées ! Un scénario pas très réjouissant… Robert Redfield, des CDC, a toutefois affirmé que les chercheurs assureront le suivi des volontaires vaccinés pendant une année complète, afin de rechercher d’éventuels effets secondaires à long terme.
Par ailleurs, un arrêt prématuré des essais pourrait empêcher les chercheurs de recruter davantage de volontaires issus de minorités. À ce jour, seul 1 participant sur 5 environ est d’origine afro-américaine ou hispanique. Or, ces populations ont été les plus sévèrement touchées par la pandémie et devraient donc représenter une plus grande part dans les essais…


Sur le même sujet : Coronavirus ; l’Australie lance des essais cliniques concernant l’utilisation du vaccin contre la tuberculose
Force est de constater que malgré l’omniprésence de la menace, la population n’est pas si pressée que ça de recevoir sa dose de vaccin. Un récent sondage mené par Gallup révèle en effet qu’un tiers des Américains refuseraient de se faire vacciner contre la COVID-19. C’est pourquoi Fauci a finalement reconnu que mettre fin à un essai plus tôt que prévu pourrait empirer la situation et saper davantage la confiance du public.
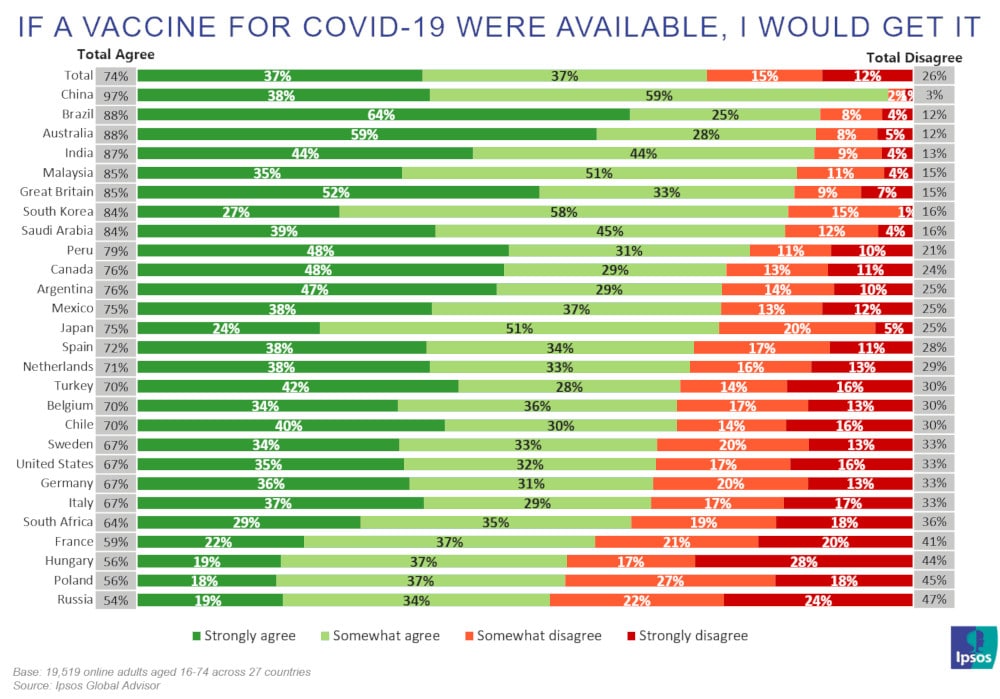
Même constat en France : un sondage mené par l’institut Ipsos montre que 74% des adultes dans le monde sont prêts à se faire vacciner, mais quatre Français sur dix se montrent réticents. Les raisons les plus fréquemment invoquées par les réfractaires : l’inquiétude quant aux effets secondaires et le doute sur son efficacité.


