Des chercheurs américains ont mis en évidence un tout nouveau type de liaison : une liaison hydrogène, qui présente une force similaire voire supérieure à certaines liaisons covalentes. Cette découverte vient remettre en question la définition de la liaison chimique et permet de mieux comprendre l’issue de certaines réactions.
Lorsque deux atomes établissent une liaison entre eux, celle-ci est plus ou moins forte. En d’autres termes, cela signifie qu’il faut plus ou moins d’énergie pour parvenir à la rompre. Jusqu’à cette récente découverte, on distinguait trois types de liaisons chimiques : la liaison covalente, la liaison ionique et la liaison hydrogène.
La liaison covalente est la plus forte ; c’est une liaison assurée par un partage d’électrons. Grossièrement, elle se forme lorsque chacun des atomes fournit un électron « célibataire » de sa couche externe. Les deux électrons s’apparient alors pour former la liaison. Elle peut également se former si l’un des atomes comporte un doublet « libre » d’électrons que l’autre atome, non pourvu d’électron célibataire, peut accepter. Les liaisons C-O du dioxyde de carbone, ou les liaisons O-H des molécules d’eau, sont des liaisons covalentes.
Les liaisons ioniques se forment entre deux atomes qui affichent une grande différence d’électronégativité, typiquement un métal et un non-métal (par exemple Na-Cl). La liaison est alors polarisée : un atome porte un excès de charge positive, l’autre un excès de charge négative. Les liaisons ioniques sont aussi considérées comme une interaction forte. Les liaisons hydrogène sont, quant à elles, des liaisons qui s’établissent entre les molécules d’eau, plus précisément, entre un atome d’hydrogène d’une molécule et l’atome d’oxygène d’une autre molécule d’eau. C’est une attraction de type électrostatique et ces liaisons sont connues pour être relativement faibles.
Un nouveau type de liaison électrostatique forte
Les trois types de liaison — covalente, ionique et hydrogène — sont relativement stables. Mais lors de réactions chimiques, alors que certaines liaisons se rompent et que d’autres se forment, il existe également des états de liaison intermédiaires, particulièrement difficiles à observer du fait qu’ils ne persistent qu’une fraction de seconde. Une équipe de chercheurs a réussi à maintenir ces états intermédiaires de façon à pouvoir les analyser. Ils ont ainsi découvert qu’il existait une liaison hydrogène de même force qu’une liaison covalente, reliant les atomes en une entité s’apparentant à une molécule.
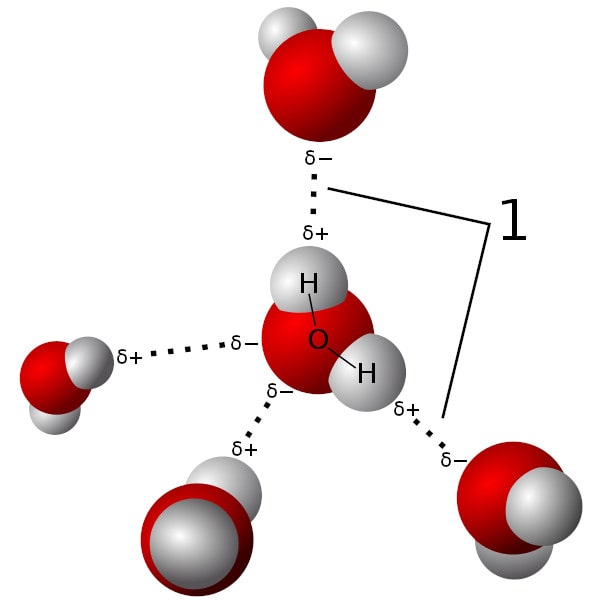
Pour parvenir à ce constat, les chercheurs ont dissous un composé de fluorure d’hydrogène (HF) dans l’eau, puis ont observé les interactions entre les atomes d’hydrogène et de fluor (qui ont une électronégativité respective de 2,2 et 3,98) par spectroscopie infrarouge bidimensionnelle femtoseconde. Ils ont alors constaté que les atomes de fluor étaient attirés par les atomes d’hydrogène du fait d’un déséquilibre de charges positives et négatives, comme dans une liaison hydrogène standard.
Chaque atome d’hydrogène était comme « pris en sandwich » entre deux atomes de fluor. Or, les liaisons de type électrostatique qui s’étaient établies pour former ces « sandwichs » s’avéraient plus fortes que les liaisons hydrogène typiques : elles affichaient une force de 45,8 kcal/mol (environ 192 KJ/mol), soit une valeur supérieure à certaines liaisons covalentes. Dans une molécule d’azote par exemple, les deux atomes d’azote sont liés via une force de 40 kcal/mol. L’ouvrage Biochemistry précise par ailleurs que les liaisons hydrogène ont une énergie généralement comprise entre 1 et 3 kcal/mol (soit 4 à 13 kJ/mol).
La définition de la liaison chimique remise en question
La liaison hydrogène joue un rôle important dans les systèmes chimiques et biologiques et est à l’origine de certaines de leurs propriétés inhabituelles. Par exemple, les points d’ébullition des composés hydrogénés les plus légers des colonnes 15 à 17 du tableau périodique des éléments — NH3, H2O, HF — sont anormalement élevés (respectivement -33°C, 100°C et 19°C). Logiquement, la température d’ébullition devrait augmenter avec la masse molaire, mais ces trois composés sont des exceptions à la règle. La raison ? La présence de forces d’attraction entre les molécules NH3, H2O, HF, qui établissent des liaisons hydrogène entre elles.
La liaison hydrogène est également responsable de la viscosité de certains liquides (tel que le glycérol, qui possède trois groupes O-H), et de la dureté de certains solides (comme le sucre, dont la molécule comporte huit groupes O-H et est de ce fait plus dur que d’autres solides moléculaires). Elle intervient également dans de nombreuses structures biologiques, telles que la structure en hélice de la plupart des protéines et de l’ADN.
Cette découverte est pour le moins inattendue et remet en question des théories admises depuis plusieurs décennies en chimie. « L’existence d’un état hybride lié covalent-hydrogène remet non seulement en question notre compréhension actuelle de ce qu’est exactement une liaison chimique, mais offre également l’opportunité de mieux comprendre les réactions chimiques, où des états de réaction intermédiaires sont souvent invoqués, mais rarement étudiés directement », soulignent dans un article parallèle des chercheurs de l’Institut Max Planck, qui n’ont pas été impliqués dans cette nouvelle étude.
Ces spécialistes ajoutent qu’il est fort probable qu’il existe des liaisons similaires dans l’eau pure. Des liaisons qui se formeraient tandis qu’un atome d’hydrogène serait pris en sandwich entre deux molécules d’eau. Même si elles n’ont jamais été observées, les chercheurs pensent que ces liaisons d’un nouveau genre existent bel et bien. Les résultats de cette étude permettront ainsi de jeter un nouveau regard sur les interactions fortes et de mieux comprendre les états réactionnels intermédiaires.


 L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]
L’électron est une particule élémentaire qui, avec les protons et les neutrons, constitue les atomes. C’est donc l’un des composants principaux de la matière baryonique. À ce titre, il revêt... [...]