Afin d’étudier le rôle d’un gène particulier dans les premières phases du développement humain, des chercheurs londoniens ont utilisé la méthode CRISPR-Cas9 pour créer des embryons génétiquement modifiés. Après cette manipulation, ils ont toutefois constaté que ces embryons avaient développé d’autres mutations génétiques non souhaitées. Une expérience qui en dit long sur d’éventuelles expérimentations futures consistant à créer des bébés génétiquement modifiés…
En génétique, les Clustered Regularly Interspaced Short Palindromic Repeats (soit « Courtes répétitions palindromiques groupées et régulièrement espacées » en français), désignées par CRISPR, sont des séquences répétées dans l’ADN. La technique appelée CRISPR-Cas9, une sorte de « ciseau génétique », est utilisée aujourd’hui dans la recherche médicale, pour introduire des modifications locales du génome (ce qui pourrait potentiellement permettre d’éliminer des allèles associés à des maladies génétiques incurables). L’approche suscite toutefois de nombreux débats centrés sur l’éthique, la sécurité et l’efficacité.
Un potentiel thérapeutique fort, mais risqué
L’équipe de chercheurs de l’Institut Francis Crick, menée par Kathy Niakan, a utilisé la méthode CRISPR-Cas9 pour supprimer un gène particulier, nommé POU5F1, dans des embryons humains (qui étaient destinés à la recherche). Après cette manipulation, ils ont comparé ces embryons génétiquement modifiés à ceux qui ne l’avaient pas été : ils ont alors découvert que près de la moitié des embryons édités contenaient aussi plusieurs modifications involontaires majeures – des ajouts ou des suppressions d’ADN – à proximité du gène cible ! Les embryons ont bien entendu été détruits après l’expérience.
Rappelons qu’à ce jour, aucun pays n’autorise la modification génétique d’embryons en vue d’une procréation médicalement assistée (un scientifique chinois a toutefois bravé cette interdiction en 2018 : il avait alors permis la naissance de deux jumelles, dont les embryons avaient été modifiés pour que leur organisme résiste au VIH). Dans le cadre d’activités de recherche, la législation diffère selon les pays ; certains interdisent complètement ce type de manipulations, d’autres les autorisent sur une période maximale de 14 jours, à l’issue de laquelle les embryons doivent être détruits.
Et c’est sans doute préférable au vu des résultats obtenus par l’équipe de Kathy Niakan. Dans leur rapport, mis en ligne sur le serveur de pré-impression bioRxiv, les chercheurs mentionnent « une faible efficacité de la réparation des mutations, des taux élevés de mosaïcisme (ndlr : un état dans lequel deux ou plusieurs populations de cellules de génotypes différents coexistent dans un individu) et la possibilité de résultats d’édition inattendus pouvant avoir des conséquences pathologiques ». Des résultats imprévus de modification du génome étaient présents dans environ 22% des cellules d’embryons humains analysés. Une manipulation qui n’augure rien de bon en somme…
Les dommages génétiques décrits dans le document pourraient entraîner des malformations congénitales ou des problèmes médicaux apparaissant plus tard dans la vie, comme le cancer. La méthode CRISPR-Cas9 est plus facile à utiliser et bien plus précise que les technologies de génie génétique antérieures. Mais bien qu’elle puisse potentiellement permettre de traiter de nombreuses maladies, elle n’est pas infaillible, comme le rappellent les chercheurs de l’Institut Francis Crick : « Nos travaux soulignent l’importance de poursuivre les recherches fondamentales pour évaluer l’innocuité des techniques d’édition du génome dans les embryons humains, ce qui éclairera les débats sur l’utilisation clinique potentielle de cette technologie ».
Dommages collatéraux
La technique d’édition de génome CRISPR-Cas9 a été mise au point en 2012 par la généticienne française Emmanuelle Charpentier, en collaboration avec Jennifer Doudna, de l’Université de Californie à Berkeley. Depuis, plusieurs équipes de scientifiques ont mené avec succès des expériences de modification génétique : pour la toute première fois en 2015, en Chine, puis en 2017 aux États-Unis (à Portland) et à Londres, dans le laboratoire de Niakan.
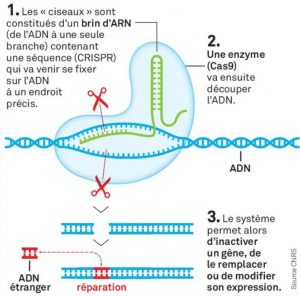
Parallèlement à ces essais fructueux, la crainte d’un usage illégal de la méthode CRISPR-Cas9 – notamment pour concevoir des bébés génétiquement modifiés – a pris de l’ampleur. Et cette peur est devenue réalité, lorsqu’en 2018, le chercheur chinois Jiankui He révélait publiquement avoir exploité CRISPR-Cas9 pour modifier des embryons, dont le développement a été mené à terme : deux jumelles sont nées en novembre 2018 de cette manipulation, provoquant un tollé parmi la communauté scientifique internationale. Il a finalement été condamné à trois ans de prison, auxquels s’ajoute une interdiction à vie de pratiquer la médecine reproductive.
L’un des problèmes soulevés par la méthode CRISPR-Cas9, et déjà bien connu des spécialistes, est l’effet « hors cible », observé parfois lorsque le ciseau génétique rate sa cible principale et intervient ailleurs dans le génome. Mais cette nouvelle expérience décrite par l’équipe de l’Institut Francis Crick met le doigt sur un autre risque : si le gène cible est bel et bien modifié, des conséquences inattendues peuvent apparaître conjointement autour de ce gène.
« Cela signifie que vous ne modifiez pas seulement le gène ciblé, mais que vous affectez tellement l’ADN voisin que vous pourriez affecter par inadvertance d’autres gènes et causer des problèmes », explique Kiran Musunuru, cardiologue à l’Université de Pennsylvanie, qui lui aussi, utilise CRISPR dans son laboratoire pour rechercher des thérapies potentielles contre les maladies cardiaques. Le cardiologue ajoute que la méthode peut générer des mutations minimes, sans gravité, mais peut également éliminer ou altérer de plus grandes sections d’ADN, ce qui s’avère bien plus problématique.
L’« ingénierie germinale » – qui consiste à modifier génétiquement les ovules, le sperme ou les embryons – peut par définition entraîner des modifications génétiques qui seront transmises à la descendance. Certains experts soulignent que cela pourrait permettre à des individus présentant une maladie génétique grave de ne pas transmettre l’anomalie à leurs enfants. Mais d’autres ont également relevé la possibilité – plus dérangeante – de concevoir par ce biais des enfants « sur mesures », plus grands, plus résistants, plus intelligents… Et c’est finalement ce qu’a réalisé Jiankui He, en modifiant un gène sain pour rendre les enfants résistants au VIH.
Sur le même sujet : Trois patients atteints de maladies génétiques traités avec succès grâce à CRISPR
Avant de songer à créer des humains « augmentés », les spécialistes s’accordent à dire qu’il reste énormément de travail à réaliser pour s’assurer que l’édition de gènes sur embryons est sans danger, non seulement pour l’individu qu’il deviendra, mais aussi pour toute sa descendance. « Il faut s’assurer que le résultat sera la naissance d’enfants sains et sans maladie, sans complications potentielles à long terme », déclare Niakan dans un article publié en 2019. « Nous sommes loin d’avoir la capacité scientifique de le faire en toute sécurité », ajoute Kiran Musunuru. Et le nouveau rapport publié par l’équipe de Niakan sur le sujet vient confirmer qu’un long chemin reste à parcourir…
En attendant, les Académies nationales américaines, la Royal Society du Royaume-Uni et l’Organisation mondiale de la santé travaillent à établir des normes internationales concernant l’utilisation de la modification du génome de la lignée germinale. Ces recommandations devraient être publiées à la fin de l’année ou en 2021. Il appartiendra toutefois à chaque pays d’adopter ces normes et de les légiférer…



