Le SARS-CoV-2, à l’origine du Covid-19, est relativement proche du virus SARS-CoV-1, responsable de l’épidémie qui a touché plus de 8000 personnes à travers le monde entre novembre 2002 et mai 2004. Mais SARS-CoV-2 s’avère bien plus agressif envers l’Homme. Pour mieux comprendre son « affinité » avec les cellules humaines, une équipe de scientifiques de l’Université du Minnesota s’est intéressée aux mutations subies par la protéine de pointe (protéine S) du coronavirus depuis sa précédente forme. Ils essayent notamment de déterminer ce qui a permis au SARS-CoV-2 de se fixer plus solidement aux cellules humaines.
Pour mettre au point un vaccin, il faut bien comprendre l’action du virus sur les cellules, ainsi que le mécanisme de reconnaissance de ses récepteurs. Autrement dit, il faut déterminer comment il parvient à se fixer sur les cellules pour les infecter, le but étant de mettre au point un produit capable d’inhiber cette action. « En général, en apprenant quelles caractéristiques structurelles des protéines virales sont les plus importantes pour établir le contact avec les cellules humaines, nous pouvons concevoir des médicaments qui les ciblent et bloquent leur activité », explique Fang Li, professeur au Département de sciences vétérinaires et biomédicales de l’Université du Minnesota.
Une liaison plus solide
Le mécanisme qui mène à l’infection est le suivant : une protéine S se trouvant à la surface d’une particule du virus vient se fixer à une protéine se trouvant en surface des cellules humaines, notamment les cellules des voies respiratoires supérieures dans le cas du SARS-CoV-2. Cette protéine fait office de récepteur pour le virus (il s’agit du récepteur ACE2 humain, noté hACE2), un peu comme une serrure et sa clé. Reste à déterminer comment la protéine S est capable de s’accrocher ainsi aux cellules humaines.
C’est l’objet d’une récente étude publiée dans Nature, dirigée par le professeur Li. Son équipe s’est ainsi penchée plus étroitement sur la protéine S du SARS-CoV-2 et sur son récepteur hACE2. Une cristallographie aux rayons X a tout d’abord permis aux chercheurs d’élaborer un modèle 3D de la protéine S, pour les deux formes du virus. Il s’agissait notamment de déterminer la structure cristalline du domaine de liaison au récepteur.
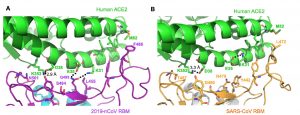
L’analyse a révélé que la protéine S avait subi quelques mutations depuis le SARS-CoV-1, notamment au niveau d’une « crête » moléculaire : celle-ci affiche une conformation différente, plus compacte. Les chercheurs en concluent que c’est sans doute ce qui a permis à cette nouvelle version du virus de mieux infecter les cellules et de se propager plus rapidement.
Une découverte qui éclaircit plusieurs points
Une autre différence notable entre le SARS de 2002 et le SARS-CoV-2 réside dans leur zone d’action, comme l’explique Jonathan Ball, professeur de virologie à l’Université de Nottingham : « Le SARS-CoV-2 infecte efficacement la gorge et le nez, provoquant de légers symptômes de rhume, tandis que le SARS se réplique presque toujours dans les poumons ». Un constat élucidé par les résultats de Li et son équipe : la protéine S du SARS-CoV-2 est capable de se lier plus efficacement à la protéine ACE2 ; or, le taux de cette dernière est moindre dans le nez et la gorge. Une liaison plus solide pourrait donc permettre au virus d’infecter ces zones.
L’équipe a par ailleurs mis en évidence le fait qu’un coronavirus de chauve-souris, le RaTG13, utilise le même récepteur humain que le SARS-CoV-2, à la différence qu’il ne parvient pas à s’y fixer aussi fortement. Si le virus est directement issu de la chauve-souris, il aurait donc nécessairement subi une mutation. L’étude de la souche issue du pangolin – qui elle aussi peut se lier au récepteur hACE2 – montre en revanche une plus grande aptitude à s’attacher aux cellules humaines, ce qui viendrait corroborer l’hypothèse selon laquelle le pangolin aurait joué le rôle d’hôte intermédiaire.
Sur le même sujet : Un nouveau traitement expérimental contre le coronavirus SARS-CoV-2 se montre efficace
Chaque nouvelle donnée sur le virus enrichit la base de connaissances qui permettra de mettre au point un vaccin ou un médicament pour le combattre. Et c’est bien l’objectif de cette nouvelle étude. « Notre travail peut guider le développement d’anticorps monoclonaux qui agiraient comme un médicament pour reconnaître et neutraliser la liaison aux récepteurs de la protéine de pointe », a déclaré Li. « Ou bien, une partie de la protéine de pointe pourrait devenir la base d’un vaccin ».
Les experts demeurent toutefois prudents. Si les résultats de Li et ses collègues sont un pas de plus vers l’élaboration d’un traitement, certains soulignent que leur analyse n’a porté que sur un fragment infime du virus – le domaine de liaison de la protéine S – et qu’une étude plus étendue permettra sans doute d’obtenir des informations complémentaires essentielles.