En fusionnant plusieurs organoïdes humains, des chercheurs ont créé des « mini-cerveaux » contenant 80 % des types de cellules cérébrales d’un embryon de 40 jours. Contrairement aux précédentes approches basées sur des groupes de cellules isolées, les nouveaux organoïdes contiennent une diversité de populations cellulaires reflétant plus fidèlement la complexité d’un cerveau complet. Cela en ferait des plateformes plus adaptées à l’étude de troubles et maladies difficiles à modéliser chez les animaux, telles que l’autisme et la schizophrénie.
Les maladies neurologiques et les troubles mentaux figurent depuis plusieurs décennies parmi les plus grands défis de la science biomédicale. D’importantes lacunes persistent dans la compréhension de l’étiologie exacte de la plupart de ces troubles, en partie en raison de l’inaccessibilité des échantillons de cerveau humain et du manque de similitude avec les modèles animaux. Cela est d’autant plus vrai pour les troubles neurodéveloppementaux, qui apparaissent souvent dès l’enfance, voire in utero.
Les organoïdes cérébraux ont considérablement amélioré notre capacité à modéliser le développement neurologique humain et les maladies qui l’affectent. Les techniques les plus récentes permettent le développement de combinaisons d’organoïdes corticaux, de régions du mésencéphale (la partie supérieure du tronc cérébral constituant le cerveau moyen) et du rhombencéphale (la partie de l’encéphale incluant le bulbe rachidien, la protubérance annulaire, le cervelet et le quatrième ventricule). Contrairement aux groupes de cellules isolées, cette combinaison a permis de mieux reproduire la structure de l’organe d’origine.
Cependant, les techniques actuelles restent limitées en raison de leur recours à des populations de cellules endothéliales simplifiées, plutôt qu’à un système endothélial complet. D’autre part, ces techniques utilisent généralement des cellules endothéliales de veine ombilicale humaine isolées (HUVEC), plutôt que des organoïdes endothéliaux. Or, ces derniers seraient des modèles plus pertinents, car ils contiennent plusieurs types de cellules reflétant plus fidèlement l’environnement neurovasculaire natif.
En effet, les systèmes endothélial et neuronal se développent en même temps et de manière synchronisée au cours du développement fœtal humain. Les deux systèmes sont interconnectés par plusieurs boucles de rétroaction régulant la structuration des organes. Il est donc essentiel de prendre ces processus en compte dans le développement des modèles in vitro des troubles neurodéveloppementaux.
Afin de combler ces lacunes, des chercheurs de l’Université Johns Hopkins ont développé des organoïdes cérébraux multirégionaux (MRBO) rassemblant les aspects clés du développement cérébral du fœtus humain en une seule structure. « Nous avons conçu des organoïdes cérébraux multirégionaux (MRBO) qui intègrent des organoïdes cérébraux, mésencéphaliques/post-encéphaliques et endothéliaux complexes en une seule structure », expliquent les experts dans leur étude, prépubliée sur le serveur biorXiv. Des chercheurs de la Harvard Medical School ont également contribué à l’étude.
80 % des groupes de cellules cérébrales des fœtus
Les études précédentes incluant les cellules endothéliales sont principalement basées sur la vascularisation des organoïdes corticaux. En d’autres termes, elles ne tenaient pas suffisamment compte des interactions complexes impliquant spécifiquement l’endothélium.
En revanche, la technique MRBO inclut différents types de cellules vasculaires, telles que des cellules progénitrices vasculaires, des cellules endothéliales matures, des péricytes, des cellules angiogéniques proliférantes et des cellules stromales. Cette diversité permettrait de modéliser plus fidèlement le développement homogène des systèmes endothélial et neuronal.
Pour ce faire, l’équipe de la nouvelle étude a utilisé trois lignées cellulaires saines pour les différencier en plusieurs types de cellules distinctes. Le protocole a été réalisé par étapes afin de différencier les souches cellulaires avant de les fusionner en un seul organoïde.
« Notre stratégie utilise une modulation séquentielle des principales voies de développement pour générer des organoïdes individuels, suivie de conditions de fusion optimisées qui maintiennent les identités régionales tout en favorisant l’intégration cellulaire », expliquent les chercheurs.
Les séquençages d’ARN unicellulaire ont montré que les MRBO obtenus présentent des populations neuronales spécifiques à chaque région du cerveau, se développant parallèlement à des populations endothéliales spécialisées. L’analyse de correspondance avec le cerveau fœtal humain a montré que les organoïdes présentaient 80 % des groupes de cellules présents au niveau du tissu cérébral des embryons âgés d’environ 40 jours (stade Carnegie 12 à 16).
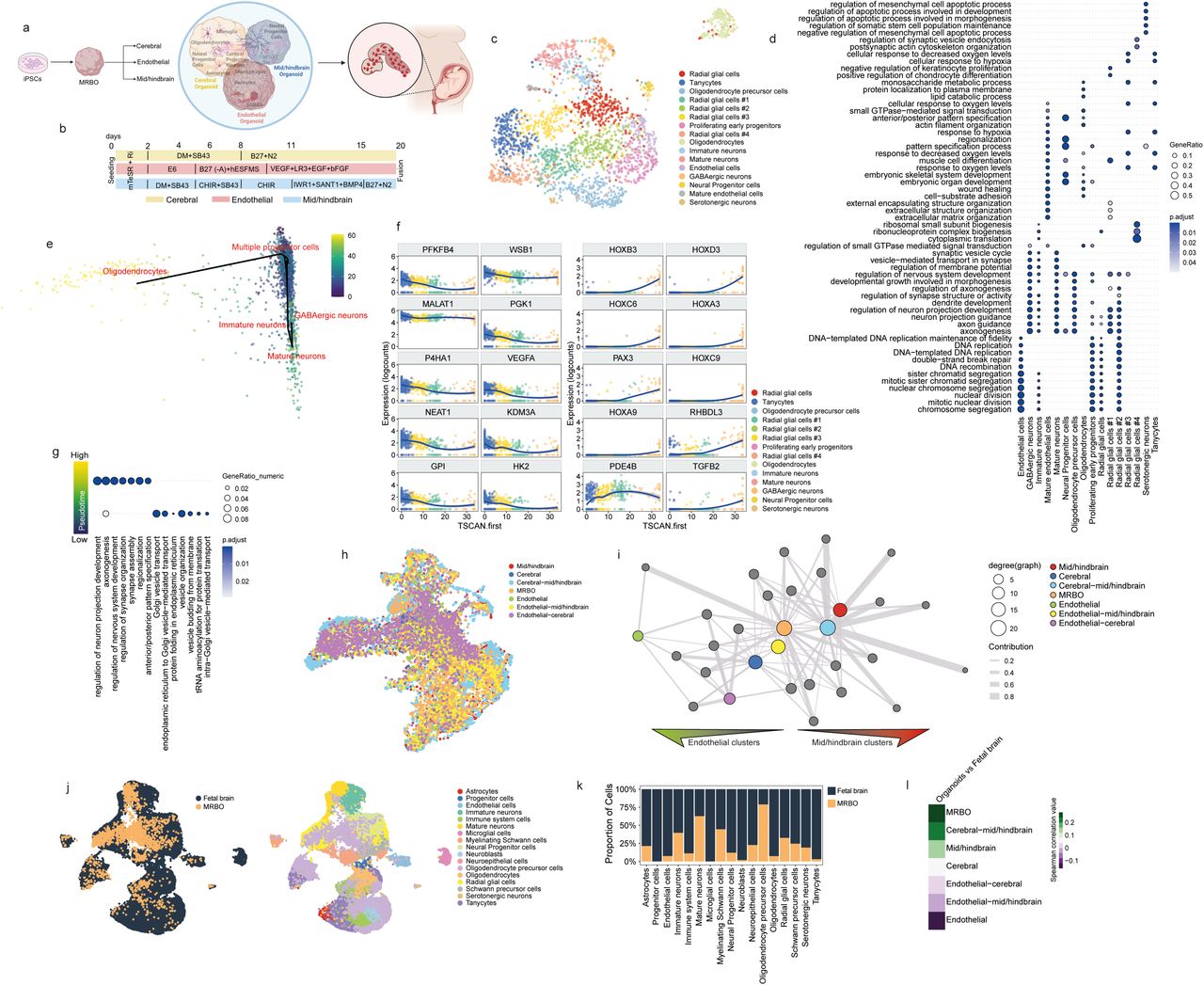


En outre, une analyse approfondie a permis d’identifier 13 interactions de signalisation endothéliale-neurale non répertoriées jusqu’à présent. Cela inclut notamment des facteurs dérivés de l’endothélium qui favorisent la prolifération des progéniteurs intermédiaires au cours du développement du mésencéphale et du cerveau postérieur. Cela met en évidence un nouveau rôle du système endothélial dans la structuration du cerveau.
Une plateforme inédite pour l’étude des troubles neurodéveloppementaux
En vue de ces résultats, les chercheurs estiment que les MRBO pourraient constituer une nouvelle génération d’organoïdes cérébraux permettant d’améliorer notre compréhension du développement cérébral. « Avec trois régions principales du cerveau et du système endothélial, les MRBO permettent l’analyse de fonctions cérébrales humaines très complexes au fil du temps », indiquent les experts.
Par ailleurs, l’équipe estime que les MRBO pourraient devenir des plateformes particulièrement pertinentes pour l’étude des effets des facteurs environnementaux et de la génétique sur le développement neuronal – des effets difficiles à modéliser sur des modèles animaux. De telles analyses pourraient contribuer à la compréhension d’affections complexes, telles que le trouble bipolaire, les troubles du spectre de l’autisme et la schizophrénie.


