Au cours des dernières années, la thérapie génique régénérative a connu un essor considérable, conduisant au développent de plusieurs techniques de génie génétique visant à lutter contre le vieillissement cellulaire. Récemment, une équipe de chercheurs est parvenue pour la première fois à inverser, en toute sécurité, le vieillissement de cellules nerveuses de l’œil chez la souris, conduisant à une nette amélioration de la vision après une perte due au vieillissement. La méthode développée par les auteurs a également permis de restaurer la vision chez des souris atteintes de glaucome. Des résultats qui, s’ils parviennent à être reproduits sur les humains, pourraient révolutionner la thérapie cellulaire et ophtalmologique.
Des neurobiologistes de la Harvard Medical School ont réussi à restaurer la vision chez la souris en rajeunissant les cellules oculaires âgées de la rétine pour qu’elles puissent retrouver leurs fonctions génomiques initiales. Le travail de l’équipe, décrit dans la revue Nature, représente la première démonstration de la possibilité de reprogrammer en toute sécurité des tissus complexes, tels que les cellules nerveuses de l’œil, à un âge plus précoce.
En plus de réinitialiser l’horloge biologique des cellules, les chercheurs ont réussi à inverser la perte de vision chez les animaux atteints d’une maladie imitant le glaucome humain, une des principales causes de cécité dans le monde. Cette réalisation représente le premier succès d’inversion de la perte de vision induite par le glaucome, plutôt que de simplement freiner sa progression. Si elle est reproduite dans le cadre d’études supplémentaires, l’approche pourrait ouvrir la voie à des thérapies visant à promouvoir la réparation des tissus dans divers organes et à inverser le vieillissement et les maladies liées à l’âge chez les humains.
« Notre étude démontre qu’il est possible d’inverser en toute sécurité l’âge des tissus complexes tels que la rétine et de restaurer leur fonction biologique juvénile », déclare David Sinclair, professeur de génétique au Blavatnik Institute de la Harvard Medical School et expert en vieillissement. Sinclair et ses collègues avertissent que les résultats doivent être reproduits dans d’autres études, y compris dans différents modèles animaux, avant toute expérience humaine.
Néanmoins, les résultats offrent une preuve de concept et une voie vers la conception de traitements pour une gamme de maladies humaines liées à l’âge. « Si elles sont confirmées par d’autres études, ces découvertes pourraient être révolutionnaires pour le soin des maladies de la vision liées à l’âge comme le glaucome et pour les domaines de la biologie et de la thérapeutique médicale en général », indique Sinclair.
Épigénome : son système de méthylation serait responsable du vieillissement
Pour son travail, l’équipe a utilisé un virus adéno-associé (AAV) comme véhicule pour délivrer dans la rétine des souris trois gènes de restauration — Oct4, Sox2 et Klf4 — qui sont normalement activés pendant le développement embryonnaire. Les trois gènes, ainsi qu’un quatrième, qui n’a pas été utilisé dans ce travail, sont collectivement connus sous le nom de facteurs Yamanaka.
Le traitement a eu de multiples effets bénéfiques sur l’œil. Premièrement, il a favorisé la régénération nerveuse après une lésion du nerf optique chez des souris présentant des nerfs optiques endommagés. Deuxièmement, il a inversé la perte de vision chez les animaux atteints d’une maladie imitant le glaucome humain. Et troisièmement, il a inversé la perte de vision chez les animaux vieillissants sans glaucome.
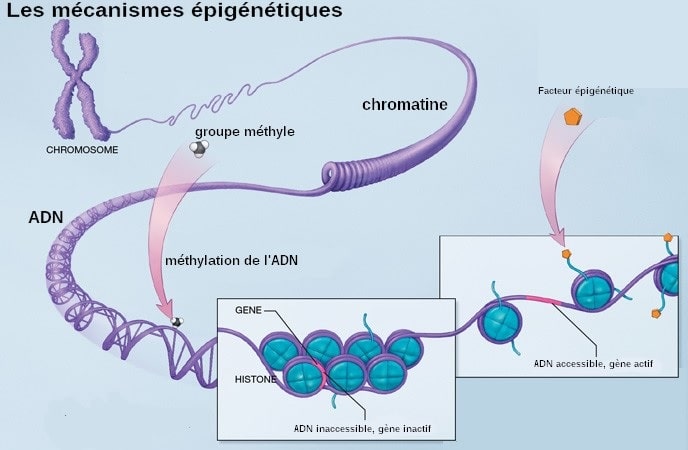
L’approche de l’équipe est basée sur une nouvelle théorie sur les raisons pour lesquelles nous vieillissons. La plupart des cellules du corps contiennent les mêmes molécules d’ADN mais ont des fonctions très diverses. Pour atteindre ce degré de spécialisation, ces cellules doivent lire uniquement les gènes spécifiques à leur type. Cette fonction de régulation est du ressort de l’épigénome, un système d’activation et de désactivation des gènes selon des schémas spécifiques sans altérer la séquence d’ADN sous-jacente de base du gène.
Cette théorie postule que les modifications de l’épigénome au fil du temps amènent les cellules à lire les mauvais gènes et à un dysfonctionnement, ce qui entraîne des maladies liées au vieillissement. L’un des changements les plus importants de l’épigénome est la méthylation de l’ADN, un processus par lequel des groupes méthyle sont collés sur l’ADN. Des schémas de méthylation de l’ADN sont établis au cours du développement embryonnaire pour produire les différents types de cellules.
Au fil du temps, les jeunes modèles de méthylation de l’ADN sont perdus et les gènes à l’intérieur des cellules qui devraient être activés sont désactivés et vice versa, entraînant une altération de la fonction cellulaire. Certains de ces changements de méthylation de l’ADN sont prévisibles et ont été utilisés pour déterminer l’âge biologique d’une cellule ou d’un tissu.
Les facteurs de Yamanaka pour contrôler la méthylation de l’ADN
Pourtant, le fait que la méthylation de l’ADN entraîne des changements liés à l’âge à l’intérieur des cellules n’est pas certain. Dans l’étude actuelle, les chercheurs ont émis l’hypothèse que si la méthylation de l’ADN contrôle effectivement le vieillissement, la neutralisation de certains de ses effets pourrait inverser l’âge des cellules à l’intérieur des organismes vivants et les ramener à leur état plus précoce et plus jeune.
Des travaux antérieurs avaient réalisé cet exploit dans des cellules cultivées en laboratoire, mais n’avaient pas réussi à démontrer l’effet sur les organismes vivants. Les nouvelles découvertes démontrent que l’approche pourrait également être utilisée chez les animaux. L’auteur principal de l’étude, Yuancheng Lu, chercheur en génétique au HMS, a développé une thérapie génique qui pourrait inverser en toute sécurité l’âge des cellules chez un animal vivant.
Le travail de Lu s’appuie sur la découverte, lauréate du prix Nobel, de Shinya Yamanaka, qui a identifié les quatre facteurs de transcription, Oct4, Sox2, Klf4, c-Myc, qui pourraient effacer les marqueurs épigénétiques sur les cellules et ramener ces cellules à leur état embryonnaire primitif à partir duquel elles peuvent se développer en tout autre type de cellule.
Une méthode sans risque de perte d’identité cellulaire ou de cancérogenèse
Des études ultérieures ont cependant montré deux revers importants. Premièrement, lorsqu’ils sont utilisés chez des souris adultes, les quatre facteurs de Yamanaka pourraient également induire une croissance tumorale, rendant l’approche dangereuse. Deuxièmement, les facteurs pourraient réinitialiser l’état cellulaire à l’état le plus primitif, effaçant ainsi complètement l’identité d’une cellule.
Lu et ses collègues ont contourné ces obstacles en modifiant légèrement l’approche. Ils ont abandonné le gène c-Myc et n’ont utilisé que les trois gènes Yamanaka restants, Oct4, Sox2 et Klf4. L’approche modifiée a réussi à inverser le vieillissement cellulaire sans alimenter la croissance tumorale ni effacer l’identité cellulaire.
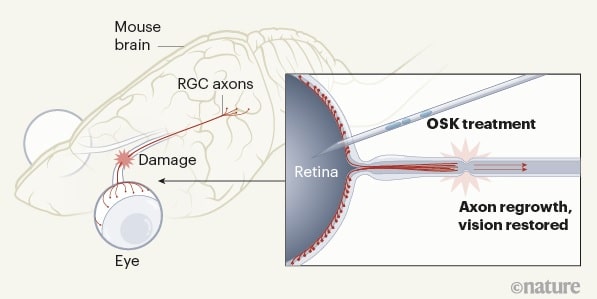


Dans l’étude actuelle, les chercheurs ont ciblé les cellules du système nerveux central, car il s’agit de la première partie du corps affectée par le vieillissement. Après la naissance, la capacité du système nerveux central à se régénérer diminue rapidement. Pour tester si la capacité de régénération des jeunes animaux pouvait être transmise à des souris adultes, les chercheurs ont administré la combinaison modifiée de trois gènes via un AAV dans des cellules ganglionnaires rétiniennes de souris adultes atteintes d’une lésion du nerf optique.
Pour leur travail, Lu et Sinclair se sont associés à Zhigang He, professeur de neurologie et d’ophtalmologie au Boston Children’s Hospital, qui étudie la neuro-régénération du nerf optique et de la moelle épinière. Le traitement a entraîné une multiplication par deux du nombre de cellules ganglionnaires rétiniennes survivantes après la lésion et une multiplication par cinq de la repousse nerveuse.
Restaurer la vision dans le cadre du vieillissement ou d’une pathologie
Suite aux résultats encourageants chez des souris atteintes de lésions du nerf optique, l’équipe s’est associée à des collègues du Schepens Eye Research Institute. Ils ont prévu deux séries d’expériences : une pour tester si le cocktail de trois gènes pourrait restaurer la perte de vision due au glaucome et une autre pour voir si l’approche pourrait inverser la perte de vision résultant du vieillissement normal.
Dans un modèle murin de glaucome, le traitement a conduit à une augmentation de l’activité électrique des cellules nerveuses et à une augmentation notable de l’acuité visuelle, telle que mesurée par la capacité des animaux à voir des lignes verticales en mouvement sur un écran. Fait remarquable, ces résultats ont été obtenus après que la perte de vision induite par le glaucome se soit produite.
Le traitement a fonctionné de manière similaire chez les souris âgées de 12 mois, dont la vision diminuait en raison du vieillissement normal. Après le traitement des souris âgées, les modèles d’expression génique et les signaux électriques des cellules du nerf optique étaient similaires à ceux des jeunes souris, et la vision a été restaurée. Lorsque les chercheurs ont analysé les changements moléculaires dans les cellules traitées, ils ont trouvé des modèles inversés de méthylation de l’ADN — une observation suggérant que la méthylation de l’ADN n’est pas un simple marqueur ou un spectateur dans le processus de vieillissement, mais plutôt un agent actif qui le conduit.



