Les causes du syndrome de fatigue chronique sont largement méconnues, alors que cette pathologie handicape des dizaines de millions de personnes à travers le monde. Récemment, deux groupes de chercheurs rapportent qu’un appauvrissement du microbiote intestinal serait associé à la survenue du syndrome de fatigue chronique, ainsi qu’à une dérégulation de la production de molécules anti-inflammatoires. Cela peut fournir un cadre pour de nouvelles voies thérapeutiques et la découverte des origines de la maladie.
L’encéphalomyélite myalgique, plus communément appelée syndrome de fatigue chronique, est une maladie invalidante jusque-là majoritairement inexpliquée, caractérisée par un éventail de symptômes incluant de la fatigue, un malaise post-effort, des troubles de la mémoire, des douleurs, un dysfonctionnement gastro-intestinal, des anomalies immunitaires et des troubles du sommeil.
La prévalence mondiale du syndrome de fatigue chronique varie entre 0,4% et 2,5%. En France, on estime qu’au moins 130 000 à 270 000 personnes sont touchées, selon l’INSERM. La maladie apparaît principalement chez les adultes de 20 à 40 ans et est plus fréquente chez les femmes que chez les hommes.
Malgré l’établissement d’un diagnostic, les patients doivent vivre avec cette maladie, car aucun traitement n’existe actuellement. Cela est en grande partie dû au fait que la ou les causes sont inconnues. Cependant, de nombreuses anomalies biologiques sous-jacentes ont été identifiées chez les personnes atteintes, notamment un métabolisme énergétique défectueux, un déséquilibre redox, des réponses immunitaires dérégulées, ainsi que de multiples anomalies du système nerveux central et autonome.
Récemment, deux études, l’une de l’Université de Colombia et l’autre du Jackson Laboratory, pointent la même origine, à savoir des microbiotes intestinaux perturbés par rapport à des individus sains, comprenant moins de types de bactéries intestinales responsables de la production de molécules anti-inflammatoires. La compréhension de la biologie de la maladie permettra à terme de développer des moyens efficaces pour la diagnostiquer, la traiter et la prévenir. Les deux études sont publiées dans la revue Cell Host & Microbe.
Un microbiote réduit
Il faut savoir que le microbiote intestinal peut influencer la santé humaine et affecter la physiologie via la résistance aux agents pathogènes, le maintien de la barrière intestinale, le métabolisme, l’immunité et la signalisation neuronale. Plusieurs études antérieures ont abouti à des conclusions quant à son implication dans le syndrome de la fatigue chronique, mais elles étaient relativement petites, avec une résolution limitée.
C’est ainsi que dans la première étude présentée ici, menée par l’Université de Columbia, Cheng Guo et ses collègues ont effectué des analyses métagénomiques et métabolomiques d’échantillons fécaux prélevés sur une cohorte géographiquement diversifiée de 106 cas et 91 témoins sains. Les résultats ont révélé des différences dans la diversité, l’abondance, les voies biologiques fonctionnelles et les interactions entre les bactéries du microbiote intestinal. Les cas et les témoins ont été appariés selon l’âge, le sexe, la géographie et le statut socio-économique.
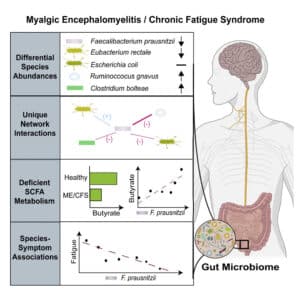
L’équipe a identifié une réduction de l’abondance des bactéries intestinales Faecalibacterium prausnitzii et Eubacterium rectale, normalement abondantes et bénéfiques pour la santé, d’environ 35% environ chez les cas présentant le syndrome de fatigue chronique. Plus précisément, l’abondance de Faecalibacterium prausnitzii est inversement associée à la sévérité de la fatigue. La seule autre espèce identifiée avec une abondance relative réduite est Coprococcus secundu, un producteur d’acétate, qui pourrait contribuer à la carence nette en cet élément.
À l’inverse, neuf espèces de bactéries présentent une abondance relative accrue chez les cas de fatigue chronique, dont certaines qui ont été associées à la fatigue dans la sclérose en plaques dans d’autres recherches.
L’auteur principal de l’étude, Brent Williams, professeur adjoint d’épidémiologie en CII à la Columbia Mailman School of Public Health, déclare dans un communiqué : « Le microbiote intestinal est une communauté écologique complexe regorgeant d’interactions inter-espèces diverses qui peuvent être bénéfiques ou nuisibles. Notre recherche révèle que chez les personnes atteintes du syndrome de fatigue chronique, il peut y avoir un recâblage important des réseaux de bactéries dans ce système ».
Éclaircir et établir de manière lisible ces réseaux présents chez les personnes atteintes de la maladie permettra de classer de manière catégorique la maladie et de la diagnostiquer de manière claire, sans que la parole du patient ne soit mise en doute.
Des différences entre les patients
La seconde étude présentée, des professeurs Derya Unutmaz et Julia Oh, et de leurs collaborateurs du Jackson Laboratory, corrobore les résultats de la précédente étude avec une précision concernant les malades à long terme et à court terme.
Concrètement, l’équipe examine les individus atteints du syndrome de la fatigue chronique, divisés en deux groupes — ceux diagnostiqués il y a moins de quatre ans ou plus de dix — ainsi que des témoins sains appariés. En plus des échantillons de sang et de selles, les chercheurs ont recueilli de nombreuses données cliniques et sur le mode de vie des participants, et ont procédé à des analyses approfondies et à haute résolution des microbiotes intestinaux.
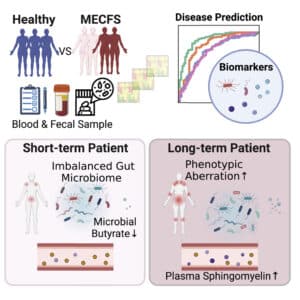
Dans l’ensemble, les échantillons de personnes atteintes du syndrome de fatigue chronique avaient des communautés microbiennes moins diversifiées, comme établi précédemment, avec un déséquilibre de la flore intestinale similaire à celui observé avec le vieillissement et les troubles inflammatoires chroniques.
Cependant, lorsque les chercheurs ont examiné séparément les groupes malades à court et à long terme, ils ont constaté que le groupe à court terme présentait la perturbation la plus importante du microbiote intestinal. L’autre groupe (long terme) était revenu à un état plus proche de celui des personnes saines, montrant une diversité microbienne plus importante et la présence de certaines espèces peu abondantes.
Néanmoins, le groupe à long terme présentait les traits les plus graves associés à la maladie, notamment la fibromyalgie et l’aggravation des problèmes de sommeil, ainsi que des anomalies métaboliques.
Mais cette étude pousse plus loin ces analyses en se penchant précisément sur les interactions hôte-microbiote dans cette pathologie, ainsi que sur les conséquences métaboliques potentielles.
Le butyrate, composant clé du diagnostic ?
Ainsi, l’équipe a découvert que les microbes de faible abondance impliqués dans la production de tryptophane, de butyrate et d’acide propionique étaient largement absents chez les personnes atteintes du syndrome de fatigue chronique. Or, ces substances sont importantes pour la régulation des fonctions métaboliques et endocriniennes, y compris la modulation des réponses inflammatoires.
Les auteurs ont découvert que l’isobutyrate plasmatique est appauvri chez les personnes malades, et que les données sur le microbiote prédisent également une abondance plus faible de butyrate et des changements dans la capacité du microbiote intestinal à métaboliser ou à synthétiser les acides gras à chaîne courte. Dans l’ensemble, la voie affecte des dizaines de métabolites plasmatiques.
C’est une conclusion partagée par la première étude. En effet, pour les deux bactéries principalement mises en cause (Faecalibacterium prausnitzii et Eubacterium rectale), les chercheurs ont découvert une capacité microbienne déficiente pour synthétiser le butyrate, le principal carburant des cellules du côlon, ajouté à la carence en acétate, utilisé par certaines bactéries pour produire du butyrate.
Pour aider à diagnostiquer, les auteurs de la seconde étude expliquent que l’épuisement des microbes de faible abondance est une caractéristique discriminatoire importante, ainsi que les niveaux de métabolites sanguins tels que la bétaïne.
J. Oh conclut dans un communiqué : « De futures études qui incluent des maladies avec des traits et des symptômes qui se chevauchent, comme le COVID long ou la fibromyalgie, seraient puissantes pour améliorer ce potentiel outil de diagnostic, et aider à l’identification de cette maladie souvent mal classée ».


