Pour la toute première fois, des scientifiques ont découvert la structure atomique d’une protéine liée à la maladie d’Alzheimer.
C’est en capturant des images (en haute résolution) de dépôts anormaux de protéines tau, soupçonnées d’être étroitement liées à la maladie d’Alzheimer ainsi qu’à d’autres maladies neurodégénératives, que des scientifiques ont pu déterminer la structure atomique de cette protéine.
Les résultats de cette découverte offriront maintenant aux scientifiques un aperçu sans précédent, de la manière dont ces dépôts nocifs fonctionnent au niveau moléculaire, et pourraient également conduire à la création de nombreux nouveaux traitements afin de les empêcher de se former, et par conséquent, aider à lutter contre la maladie d’Alzheimer ainsi que d’autres maladies neurodégénératives. « C’est un énorme pas en avant », annonce un membre de l’équipe, Bernardino Ghetti, de l’Université d’Indiana, aux États-Unis. « Il est clair que (la protéine) tau est extrêmement importante concernant la progression de la maladie d’Alzheimer et de certaines formes de démence. En termes de conception d’agents thérapeutiques, les possibilités sont maintenant énormes », ajoute-t-il.
Les chercheurs, dirigés par le MRC Laboratory of Molecular Biology (LMB) au Royaume-Uni, ont réussi à extraire des filaments de protéines tau, à partir du cerveau d’un patient décédé avec un diagnostic confirmé de la maladie d’Alzheimer et les ont imagées en utilisant une technique appelée cryo-microscopie électronique (cryo-ME). Cette technique permet de réduire les dommages d’irradiation causés par le faisceau d’électrons et permet également de préserver la morphologie et la structure des échantillons biologiques.
La maladie d’Alzheimer est liée à l’accumulation de deux types de dépôts anormaux de protéines : les filaments de tau, qui se forment à l’intérieur des cellules nerveuses, et des protéines bêta amyloïdes, qui se développent à l’extérieur des cellules. Pour un cerveau sain, la protéine tau agit comme un stabilisateur, mais lorsque les protéines sont défectueuses, elles peuvent générer des faisceaux de filaments enchevêtrés. Cela entrave la communication entre les cellules, conduit à la neurodégénérescence et réduit les capacités cognitives.
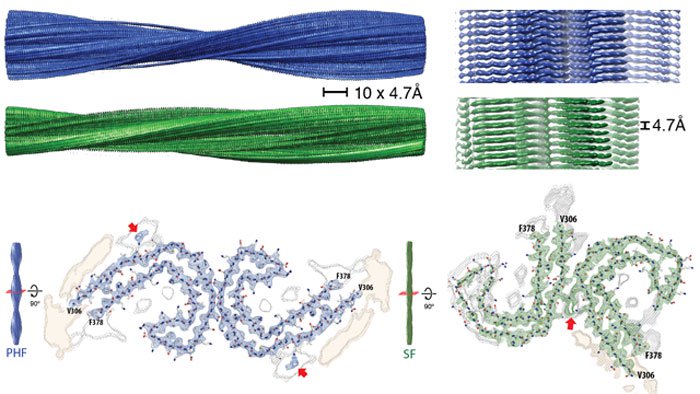
Cela fait des décennies que les chercheurs étudient l’implication de la protéine tau dans la maladie d’Alzheimer, mais jusqu’à présent, aucun chercheur n’avait réussi à observer ces filaments avec une telle précision. Mais les prouesses de l’imagerie cryo-ME réalisées ici, pourraient aider à la création de nouveaux médicaments, ciblant la protéine tau.
« Créer des médicaments qui pourraient éliminer ces résidus de protéines dans le cerveau est l’objectif des chercheurs, mais pour affecter directement ces protéines, les molécules qui constituent un médicament doivent pouvoir se verrouiller et se lier à leur surface », explique le Dr Rosa Sancho, responsable des recherches à l’Alzheimer’s Research UK. « Connaître la forme précise de ces structures complexes de protéines est très utile pour guider le développement de médicaments ciblés », précise-t-elle.
De nombreuses études sont actuellement menées sur les protéines tau, ainsi que sur les amyloïdes anormales, afin de mieux comprendre leur fonctionnement. Mais nous ne savons pas à quel point des échantillons artificiels créés en laboratoire peuvent différer avec de réels tissus humains. Mais grâce aux structures tau obtenues auprès du patient décédé, les chercheurs ont maintenant la capacité d’étudier comment ces filaments anormaux fonctionnent au niveau atomique, dans le cerveau humain. « C’est la première fois que quelqu’un a déterminé la structure à haute résolution [à partir d’échantillons de cerveau humain] pour l’une de ces maladies. La prochaine étape consiste à utiliser cette information pour étudier les mécanismes de neurodégénérescence », explique le neuroscientifique Michel Goedert.
L’équipe suggère que ces résultats présentent l’une des majeures découvertes de ce dernier quart de siècle dans le domaine de recherche de la maladie d’Alzheimer. À présent, les scientifiques vont poursuivre leurs travaux et continuer d’étudier ces enchevêtrements. « C’est comme tirer dans le noir – vous pouvez toucher quelque chose, mais vous aurez bien plus de chances de toucher quelque chose si vous en connaissez la structure. Cette recherche ouvre vraiment une toute nouvelle ère dans ce domaine de recherche », a expliqué l’équipe de recherche.