Des chercheurs ont montré que la maladie d’Alzheimer héréditaire peut être transmise par le biais d’une transplantation de moelle osseuse ou d’une simple transfusion sanguine. Lorsque des cellules souches de moelle osseuse provenant de souris porteuses du gène de la maladie ont été implantées chez des souris saines, celles-ci ont développé la pathologie de façon accélérée. Les résultats suggèrent que contrairement à l’hypothèse conventionnelle, la physiopathologie de la maladie pourrait être d’origine systémique.
Les transfusions de sang et de plaquettes, la transplantation d’organes et de moelle osseuse ainsi que les thérapies cellulaires constituent des interventions cliniques essentielles. Cependant, bien qu’elles permettent de traiter des pathologies complexes, une préoccupation subsiste quant à leur innocuité. Non seulement leur application exige une vigilance accrue par rapport aux réactions immunitaires des receveurs, mais elles sont également susceptibles de transmettre des maladies à prions, notamment.
Les maladies à prions sont des affections neurodégénératives caractérisées par une protéine infectieuse (prion), qui peut se transmettre de manière interhumaine et iatrogène — c’est-à-dire par le biais d’interventions médicales ; par exemple par une transfusion sanguine ou des instruments chirurgicaux contaminés. Elles peuvent aussi se transmettre entre les espèces par le biais de la chaîne alimentaire et sont présentes chez de nombreux mammifères, tels que les bovidés et les cervidés. Parmi les exemples les plus connus figurent la maladie de Creutzfeldt-Jakob ou la maladie de la « vache folle ».
Récemment, il a été suggéré qu’Alzheimer pourrait être une maladie à prions dans laquelle des protéines bêta-amyloïdes mal repliées seraient responsables de l’infection. Des rapports ont fait état de transferts interhumains de la maladie par le biais d’hormones de croissance dérivées de l’hypophyse humaine cadavérique (c-hGH) contaminées. Bien qu’après injection de l’hormone les patients sont décédés de la vache folle selon le diagnostic initial, les enquêtes post-mortem ont révélé d’importants niveaux de plaques bêta-amyloïdes au niveau cérébral.
D’un autre côté, des recherches ont mis en évidence que des protéines bêta-amyloïdes présentes dans le sang peuvent traverser la barrière hématoencéphalique et contribuer de manière significative à la pathogénicité d’Alzheimer. Ces constats sont en contradiction avec l’hypothèse conventionnelle de la maladie, selon laquelle l’accumulation de cette protéine est principalement d’origine cérébrale. Cependant, ces études ne permettaient pas de déterminer de manière concluante si les plaques bêta-amyloïdes générées au niveau du cerveau peuvent être corrélées au mécanisme des maladies à prions.
Une nouvelle étude menée par des chercheurs de l’Université de la Colombie-Britannique semble confirmer ces observations, révélant qu’Alzheimer d’origine héréditaire peut être transmise par le biais d’une transplantation de moelle osseuse ou d’une transfusion sanguine. « Cela conforte l’idée selon laquelle la maladie d’Alzheimer est une maladie systémique dans laquelle les amyloïdes exprimées à l’extérieur du cerveau contribuent à la pathologie du système nerveux central », explique dans un communiqué de presse le coauteur principal de la recherche, Wilfred Jefferies. Sur la base de leur découverte, les chercheurs suggèrent que les donneurs de sang, de tissus, d’organes et de cellules souches devraient être dépistés pour la maladie d’Alzheimer, afin d’éviter son transfert par inadvertance. Les résultats de l’étude sont détaillés dans la revue Stem Cell Reports ISSCR.
Des déclins cognitifs dès 6 mois après la transplantation
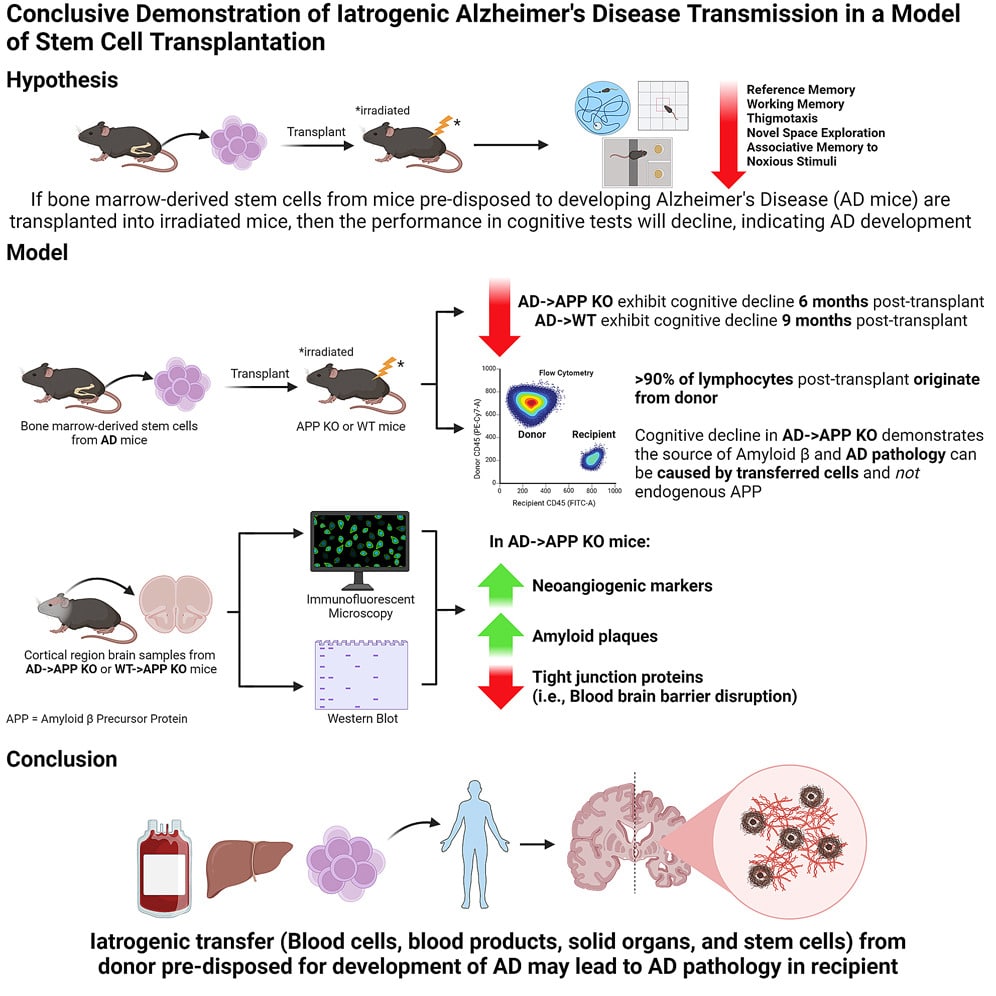
Afin de déterminer si l’amyloïde d’origine systémique pouvait provoquer Alzheimer, les chercheurs ont transplanté des cellules souches provenant de la moelle osseuse de souris, porteuses d’une variante du gène exprimant la protéine précurseur de l’amyloïde humaine (APP). Lorsqu’elle est mal repliée, cette dernière forme les plaques amyloïdes caractéristiques de la maladie. La transplantation a été effectuée sur des souris dont le gène APP a été désactivé (knock-out APP) et sur un autre lot portant le gène APP normal (ou activé).
Les chercheurs ont constaté que les souris transplantées présentaient beaucoup plus rapidement des symptômes de déclin cognitif que les souris donneuses. En effet, ces dernières présentent des changements cérébraux entre 9 et 10 mois et montrent des signes de déclin cognitif entre 11 et 12 mois. Cela se manifeste par une absence de peur et une perte de mémoire à court et long terme. En revanche, celles transplantées ont montré des symptômes dans les 6 mois suivant la transplantation.
Plus étonnant encore, les souris knock-out APP ont développé des symptômes à 6 mois après la transplantation, tandis que celles ayant le gène activé ont montré un déclin cognitif à 9 mois. « Le fait que nous puissions observer des différences comportementales significatives et un déclin cognitif chez les souris knock-outs APP à 6 mois était surprenant, mais aussi intriguant, car cela montre simplement l’apparition de la maladie qui s’accélère après son transfert », explique l’auteur principal de l’étude, Chaahat Singh, également de l’Université de la Colombie-Britannique. En outre, les deux groupes de souris transplantées présentaient des caractéristiques moléculaires et cellulaires typiques de la maladie, telles qu’une hyperperméabilité de la barrière hématoencéphalique et une accumulation de protéines amyloïdes dans le cerveau.
Ces résultats suggèrent que la maladie peut être transmise à des organismes en bonne santé dépourvus d’une prédisposition génétique. De plus, étant donné que les cellules souches transplantées étaient hématopoïétiques (pouvant se différencier en cellules sanguines et immunitaires, mais pas en neurones), la présence d’amyloïdes dans le cerveau de souris knock-out APP montre que la maladie peut résulter de protéines produites en dehors du système nerveux central. Par ailleurs, l’étude met en évidence une possibilité de transmission interespèce, le gène APP des souris donneuses de cellules souches étant humain.
En prochaine étape, les experts prévoient d’étudier si l’effet inverse est possible, c’est-à-dire si la transplantation de tissus de souris normales à des souris atteintes d’Alzheimer héréditaire pourrait atténuer la maladie. Il est également prévu de vérifier si la maladie est transmissible via d’autres types de greffes ou de transfusion, ainsi que d’élargir l’enquête sur le transfert interespèce de la maladie.