En ajoutant des électrons à de l’ammoniac liquide, celui-ci passe du bleu vif à un aspect bronze métallique brillant. Les détails de cette transformation, qui traduit le passage d’un non-métal à un métal, n’avaient jusqu’à présent pas été véritablement éclaircis. Une nouvelle étude parue dans Science vient aujourd’hui lever le voile sur cette réaction chimique centenaire… D’ailleurs, nous avions déjà publié un premier article sur le sujet il y a peu.
Pour comprendre les mécanismes de cette réaction, les chercheurs ont utilisé la technique du microjet, qui consiste à projeter de minces flux de solution (aussi fins qu’un cheveu) à travers un faisceau de rayons X. Les résultats de leurs expérimentations pourraient notamment ouvrir la voie à de nouveaux types de réactions en chimie organique.
Une couleur qui dépend de la concentration d’électrons
Les métaux regroupent des éléments très diversifiés, aux propriétés physiques et chimiques différentes. Leur point commun est qu’ils sont tous conducteurs d’électricité. Pourquoi ? Car les atomes métalliques possèdent des électrons libres, qui sont faiblement liés au noyau et qui peuvent se déplacer comme bon leur semble. Dans un métal, les atomes partagent leurs électrons libres jusqu’à former une sorte de gaz électronique global. Si on applique un champ électrique, celui-ci entraînera le déplacement des électrons, donc un courant électrique.
Comment certains non-métaux peuvent-ils se transformer en métaux ? Les études expérimentales destinées à analyser le comportement des électrons en excès (donc libres) dans les liquides se sont pour la plupart limitées à des concentrations d’électrons très faibles. Une équipe de chercheurs s’est intéressée cette fois-ci à ce qu’il se passait en cas de plus fortes concentrations d’électrons dans de l’ammoniac liquide.
Pour commencer, ils ont condensé l’ammoniac, qui est sous forme gazeuse à température ambiante, pour obtenir sa forme liquide, en le refroidissant à -33°C. Ils ont ensuite ajouté du sodium, du lithium ou du potassium, qui sont tous des métaux alcalins (caractérisés notamment par le fait qu’ils perdent facilement leur électron de valence – celui qui se trouve le plus éloigné du noyau atomique).
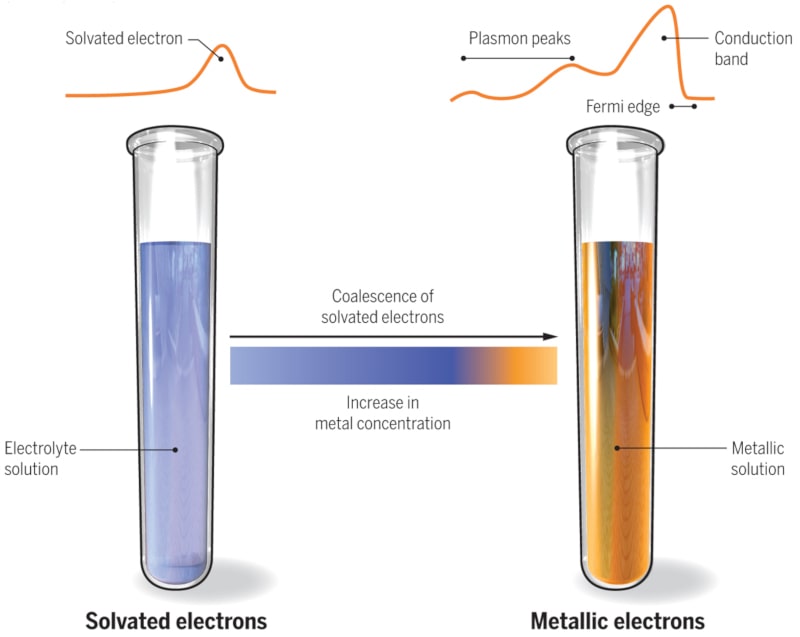
Le résultat était conforme à leurs attentes : l’ammoniac liquide avait « arraché » des électrons au métal. Ceux-ci se sont alors retrouvés piégés entre les molécules d’ammoniac, créant des « électrons solvatés » (des électrons libres), objets de l’étude. À de faibles concentrations du métal, l’ammoniac liquide a immédiatement pris une teinte bleu foncé, caractéristique de la présence d’électrons solvatés. Mais au fur et à mesure que les électrons piégés s’accumulaient, la solution passait au bronze brillant.
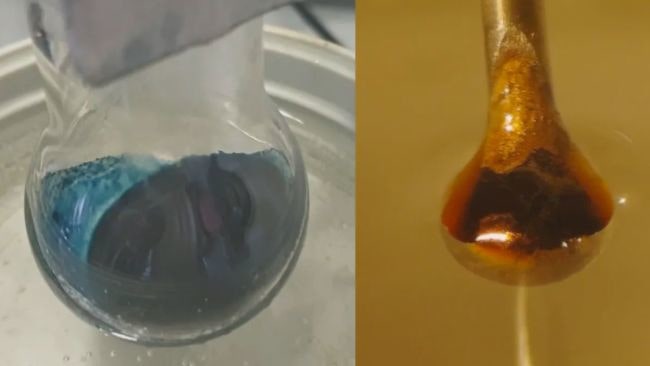
Les expériences ont été réalisées en collaboration avec des chercheurs de l’Académie tchèque des sciences et de l’Institut Fritz-Haber de la société Max Planck à Berlin, ainsi que des chercheurs du Japon et de France. Pour étudier le comportement des électrons solvatés à différentes concentrations, ils ont utilisé la technique du microjet, qui consiste à propulser un infime jet de la solution – de la largeur d’un cheveu humain – à travers un faisceau de rayons X synchrotron, soit un faisceau à haute énergie.
Ces rayons X ont permis d’exciter les électrons solvatés, qui ont par conséquent « sauté » hors de leur cage liquide de molécules d’ammoniac. Les chercheurs ont ensuite pu mesurer la quantité d’énergie qui a été nécessaire pour libérer ces électrons.
Une piste vers des réactions organiques inédites
Ils sont arrivés à la conclusion que plus la concentration en électrons solvatés était élevée, plus le schéma de libération d’énergie devenait caractéristique d’un « vrai » métal. En effet, au fur et à mesure que la concentration en électrons augmentait, les chercheurs ont observé un pic étroit d’énergie, situé à environ 2 électronvolts (eV) – correspondant au « détachement » d’électrons – se transformant en une bande de conduction avec un niveau de Fermi, précédée d’un pic de plasmon (une oscillation de plasma quantifiée), caractéristique des électrons métalliques délocalisés.
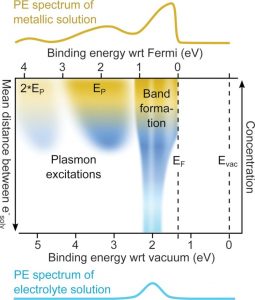
À des concentrations inférieures d’électrons solvatés, le graphique de libération d’énergie ressemble à une colline arrondie. Ce n’est qu’à des concentrations plus élevées que cette transition abrupte apparaît. « Cette valeur seuil reflète la quantité d’énergie des électrons à une température donnée », explique Ryan McMullen, doctorant en chimie à l’Université de Californie du Sud et co-auteur de l’étude. Pour McMullen et ses collaborateurs, les résultats étaient intéressants, car ils ont montré qu’un liquide de type métal, créé en combinant les métaux alcalins et l’ammoniac, devient réellement un métal du point de vue de la physique fondamentale. Ce n’est donc pas juste une substance qui ressemble à un métal.
Sur le même sujet : Des physiciens parviennent enfin à expliquer un concept utilisé quotidiennement en chimie
Les électrons solvatés à plus faible concentration sont utilisés dans une réaction appelée « réduction de Birch », qui consiste à ajouter des électrons aux composés aromatiques (des structures moléculaires cycliques et planes). On effectue la réduction d’un noyau aromatique par un métal (sodium, lithium ou potassium) dans l’ammoniac liquide. C’est une réaction couramment utilisée en synthèse organique, car elle permet de créer facilement des diènes cycliques non conjugués. Elle a notamment contribué à la fabrication des premières pilules contraceptives orales dans les années 1950.
En comprenant aujourd’hui comment les électrons solvatés fonctionnent à des concentrations élevées, les scientifiques peuvent potentiellement trouver de nouveaux types de réactions chimiques. Ils pourraient par exemple exciter les électrons solvatés avec des faisceaux de lumière pour les amener à se comporter façon différente et provoquer des réactions jusque-là inédites.



 L’électron est une particule élémentaire qui, avec les protons et
les neutrons, constitue les atomes. C’est donc l’un des composants
principaux de la matière baryonique. À ce titre, il revêt... [...]
L’électron est une particule élémentaire qui, avec les protons et
les neutrons, constitue les atomes. C’est donc l’un des composants
principaux de la matière baryonique. À ce titre, il revêt... [...]