Tandis que la pandémie continue de toucher de nombreux pays et que les premiers vaccins commencent à être délivrés aux personnes en ayant le plus besoin, les scientifiques tentent toujours de mieux comprendre le coronavirus SARS-CoV-2 et son impact sur l’organisme. Dans ce cadre, des chercheurs ont développé un modèle pathologique murin de la COVID-19 afin d’étudier précisément par quels mécanismes le virus déclenche les défaillances organiques que l’on observe dans les cas les plus sévères de la maladie. Les résultats devraient apporter de précieuses informations et déboucher sur des thérapies plus efficaces.
Des biologistes ont créé un modèle murin unique de la COVID-19, capable de révéler comment le virus SARS-CoV-2 entraîne les différentes défaillances organiques constatées dans le cadre de la maladie. Bien que ce modèle expérimental ne corresponde pas directement aux cas de coronavirus humains, c’est une percée à d’autres égards, nous donnant un système de test potentiel pour explorer comment l’agent pathogène s’étend bien au-delà du système respiratoire dans de nombreux cas d’infection.
« Ce modèle murin est un outil vraiment puissant pour étudier le SARS-CoV-2 dans un système vivant », explique le cardiologue Arjun Deb de l’UCLA. Des modèles murins de COVID-19 ont déjà été conçus, mais aucun ne nous a permis d’atteindre ce point, selon les chercheurs, en démontrant à quoi ressemblent les manifestations extrapulmonaires de la COVID-19.
Faciliter l’accès du virus aux récepteurs ACE2
Cela a été une limite importante pour la recherche animale sur la progression du virus, et cela pour plusieurs raisons. Alors que les cellules de souris contiennent un analogue du récepteur ACE2 que le SARS-CoV-2 utilise pour se lier aux cellules humaines, le virus ne semble pas se fixer à la version murine de la molécule. Le génie génétique des souris avec la version humaine de l’ACE2 fournit une sorte de solution de contournement, mais auparavant, les scientifiques n’avaient pas réussi à induire une défaillance d’organes multiples chez la souris.
Le manque de données à ce sujet peut être dû au fait que des études antérieures utilisaient l’inoculation nasale sur des souris, infectant les animaux avec le SARS-CoV-2 par le nez, ce qui ne semble pas se développer en infections globales à l’échelle du système chez la souris. Dans la nouvelle étude, dirigée par Shen Li, cardiologue à l’UCLA, l’équipe a contourné ce problème en injectant le virus dans la circulation sanguine de souris modifiées, où il pourrait atteindre la version humaine du récepteur ACE2 (appelée hACE2) dans le cœur et d’autres organes vitaux.
Être en mesure d’étudier l’infection systémique induite chez les souris infectées par le SARS-CoV-2 pourrait considérablement élargir nos connaissances sur les capacités d’extension du virus dans les cas humains. Une telle connaissance est cruellement nécessaire. « Parmi les patients atteints de COVID-19, ceux qui ont des organes impliqués autres que les poumons sont les plus à risque de mauvais pronostic. Nous avons donc pensé qu’il était vraiment important de comprendre comment le virus affecte ces autres organes », explique Deb.
Atteintes organiques et modifications épigénétiques
Dans l’expérience, l’administration systémique de l’infection a provoqué des résultats rapides. Dans les sept jours, les souris infectées ont démontré une morbidité profonde, une activité sévèrement restreinte, et ont été retrouvées blotties au coin de la cage, contrairement à un groupe témoin de souris de conception similaire qui ont été épargnées par l’infection, restant en bonne santé.
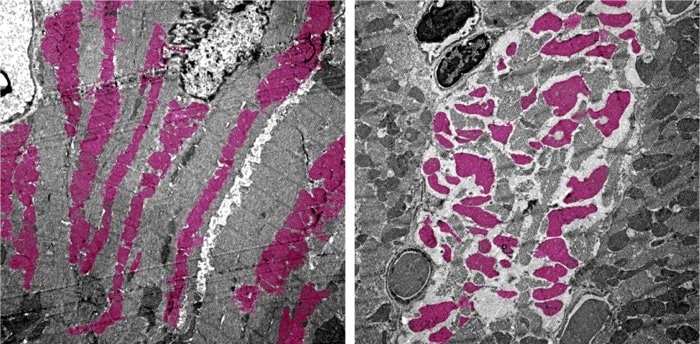
Dans le même laps de temps, les souris infectées ont perdu jusqu’à environ 25 pour cent de leur poids corporel en raison d’une consommation alimentaire fortement réduite, nécessitant une euthanasie. Les souris infectées avaient également des rates endommagées, une activité cardiaque et une pression artérielle irrégulières et des niveaux de cellules immunitaires altérés — tous des symptômes ressemblant à des cas humains de COVID-19.
Après l’euthanasie des animaux, l’analyse de leurs organes a révélé des changements dans l’expression des gènes dans plusieurs tissus, perturbant les processus cellulaires qui génèrent de l’énergie dans le corps. « Si un virus étouffe les voies de génération d’énergie dans plusieurs organes du corps, cela va vraiment faire des ravages », explique Deb.
Au-delà de ces effets, les souris infectées montraient également de nombreux signes de changements épigénétiques, ce qui pourrait expliquer la modification de l’expression génique évidente dans plusieurs organes. On ne le sait pas avec certitude, mais ces impacts pourraient potentiellement être ressentis longtemps après qu’une infection a été vaincue par le système immunitaire et, hypothétiquement parlant, pourraient être à la base des symptômes prolongés ressentis par les « longs COVID ».