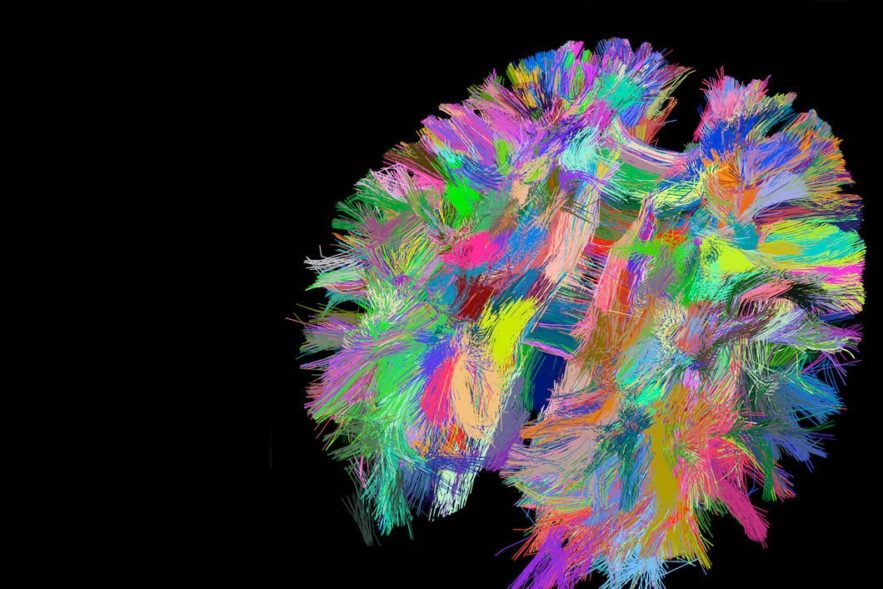
Des chercheurs de l’Université Duke ont utilisé la stimulation cérébrale profonde, basée sur la lumière, pour traiter la dysfonction motrice liée à la maladie de Parkinson. Leur méthode permettra de mieux comprendre comment fonctionne la stimulation cérébrale profonde et ainsi, d’améliorer la technique pour l’adapter à chaque cas. Les résultats de cette étude viennent d’être publiés dans The Journal of Neuroscience.
La stimulation cérébrale profonde du noyau sous-thalamique est une thérapie efficace pour soigner les symptômes moteurs de la maladie de Parkinson. Cependant, les éléments neuronaux impliqués dans le soulagement des symptômes ne sont pas clairement identifiés. Warren Grill, professeur distingué en génie biomédical et co-auteur de l’étude, explique qu’il existe un débat de longue date sur la question de savoir si ce traitement affecte les corps des cellules nerveuses, leurs axones, ou bien les deux simultanément.
Objectif : identifier l’élément neuronal sensible à la stimulation profonde
Les méthodes traditionnelles, basées sur la stimulation électrique du cerveau profond, n’ont pas permis jusqu’à présent de répondre à la question, car elles affectent le système nerveux dans sa globalité. Or, la nouvelle méthode proposée par Grill et ses collègues, basée sur la lumière, permet de cibler un élément bien précis du corps cérébral. Il devient donc possible d’observer les effets individuels de l’activation de différents éléments neuronaux. Ces éléments à évaluer sont :
-
- les neurones qui composent le noyau sous-thalamique, un composant du système de contrôle des ganglions de la base, qui sont impliqués dans la programmation et l’exécution des mouvements. Sa fonction exacte reste encore inconnue, mais des recherches antérieures suggèrent qu’il tient en échec les réponses musculaires ;
- les longues fibres nerveuses (axones), appelées « la voie hyperdirecte », qui s’étendent dans la région des neurones du cortex cérébral, la substance grise périphérique responsable de la plupart des traitements de l’information du cerveau ;
- et enfin, différents types de cellules de soutien présentes dans tout le cerveau.
Par stimulation électrique, il est presque impossible de démêler le rôle de tous ces types de cellules, car on ne peut pas les distinguer. En outre, les impulsions électriques « aveuglent » les capteurs des chercheurs pendant une milliseconde cruciale directement après leur lancement. Pour pallier le problème, en 2006, une équipe de chercheurs a tenté d’utiliser l’optogénétique : il s’agit d’une modification génétique de cellules spécifiques, pour exprimer des canaux ioniques sensibles à la lumière, permettant aux chercheurs de contrôler leur activité via des impulsions lumineuses.
Les chercheurs ont alors intégré ces canaux ioniques dans les neurones du noyau sous-thalamique chez le rat, puis ont émis des impulsions lumineuses au même rythme que celui utilisé dans la stimulation cérébrale profonde. Cependant, le traitement n’a réussi à atténuer aucun des symptômes physiques des rats. De ce fait, les chercheurs en ont conclu que la stimulation du noyau sous-thalamique à lui seul est une approche inadéquate.
Mais le professeur Grill demeurait sceptique sur cette expérimentation et sur ces conclusions : « Les neurones stimulés par l’optogénétique ne réagissent généralement pas très rapidement, et il m’a semblé que les chercheurs faisaient clignoter leurs lumières plus rapidement que les neurones ne pouvaient suivre ». Une théorie confirmée par les données de l’étude, car les neurones semblaient répondre de manière aléatoire et non en synchronisation avec les flashs lumineux. Or, les recherches antérieures menées par l’équipe de Grill ont montré que les schémas aléatoires de stimulation cérébrale profonde ne sont pas efficaces pour soulager les symptômes.
Vers une stimulation cérébrale « à la carte »
Grill souhaitait donc améliorer cette méthode prometteuse. Par chance, une nouvelle forme d’optogénétique, plus rapide, venait d’être développée. Baptisée Chronos, cette technique était susceptible d’assurer les vitesses traditionnellement utilisées dans la stimulation cérébrale profonde. Par ailleurs, l’équipe de Grill s’est enrichie d’un spécialiste en optogénétique, Chunxiu Yu.
Dans le cadre de cette nouvelle expérimentation, Yu a intégré la machinerie optogénétique Chronos dans les neurones du noyau sous-thalamique de rats, dont la moitié du cerveau avait été lésée de manière à exprimer les conditions types de la maladie de Parkinson (les symptômes moteurs qui en résultent ne se produisent ainsi que d’un côté du corps du rat). Ils ont ensuite réalisé une stimulation cérébrale profonde en utilisant des flashs lumineux à une fréquence de 130 impulsions par seconde. Résultat : les symptômes physiques des rats ont été considérablement atténués.


Ces résultats encourageants confirment que le facteur cinétique est essentiel dans les approches optogénétiques : des vitesses de stimulation élevées ont produit un soulagement des symptômes, tandis que des vitesses faibles étaient inefficaces. En outre, l’étude a permis de mettre en évidence la façon dont d’autres neurones – en dehors du noyau sous-thalamique – ont répondu au traitement, ce qui fournit des indices supplémentaires sur le fonctionnement de la stimulation cérébrale profonde. En offrant ainsi une vision plus claire de l’activité neuronale, cette nouvelle technique devrait permettre aux chercheurs de déterminer exactement quelles parties du cerveau doivent être stimulées, et ainsi, de développer des thérapies « à la carte » pour traiter les dysfonctionnements de contrôle moteur au cas par cas.
Sur le même sujet : Ce traitement pourrait à l’avenir inverser l’évolution de la maladie de Parkinson
Grill et ses collègues prévoient à présent de recréer la même expérimentation, mais dans la voie hyperdirecte (au niveau des axones) pour voir dans quelles mesures elle contribue au soulagement des symptômes. « C’est très important, parce que quelque part dans ce « grand bol de spaghettis » se trouvent certains éléments qui jouent un rôle dans le traitement des symptômes et d’autres qui génèrent des effets secondaires », explique Grill. « Et si nous pouvons déterminer précisément qui fait quoi, nous pouvons concevoir des modèles d’électrodes de stimulation ciblant les éléments adéquats, sans impacter les autres ».