Des scientifiques de l’Université baptiste de Hong Kong (HKBU) ont développé une technique qui permet d’obtenir des médicaments plus purs, et qui n’engendrent pas les effets secondaires généralement observés. Cette technique consiste à agir sur la structure géométrique des molécules. Leurs recherches, dont les résultats sont parus dans la revue National Chemistry, ouvrent la voie à une production en masse de médicaments plus efficaces, moins chers et plus écologiques.
Une même molécule peut parfois afficher deux configurations géométriques différentes ; l’une de ses liaisons peut par exemple avoir une direction différente dans l’espace sous l’une et l’autre forme. Il faut savoir que dans l’industrie pharmaceutique, lorsque l’on synthétise un médicament composé d’une telle molécule, on obtient souvent un mélange de ses deux formes. Or, si l’une présente un effet thérapeutique avéré, l’autre peut parfois entraîner des effets secondaires néfastes. Des chimistes de Hong Kong proposent aujourd’hui une solution à ce problème.
Une légère différence aux lourdes conséquences
Certains objets sont identiques à leur image dans un miroir et peuvent lui être superposés (ex. une fourchette, des lunettes…). D’autres ne le sont pas. Prenez l’exemple de vos mains : votre main gauche est l’image de votre main droite face à un miroir ; mais si vous mettez vos deux mains l’une sur l’autre, elles ne se superposent pas tout à fait : vos deux pouces partent dans des directions opposées.
Il en est de même pour les molécules. Lorsqu’une molécule n’est pas superposable à son image dans un miroir, on dit qu’elle est chirale, ou qu’elle possède la propriété de chiralité (prononcez « kirale » et « kiralité »). Une telle molécule existe donc sous deux formes géométriques distinctes, symétriques l’une de l’autre par rapport à un plan ; ces formes sont appelées des énantiomères.
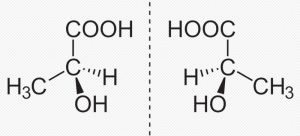
Les énantiomères ont des propriétés physiques (température de fusion et d’ébullition, densité, etc.) identiques, à l’exception d’une seule : ils exercent une action opposée sur la lumière polarisée plane ; l’un est dit dextrogyre (il fait tourner le plan vers la droite), l’autre est lévogyre (il fait tourner le plan vers la gauche). Les chimistes utilisent plutôt la nomenclature R/S, pour Rectus (droit) et Sinister (gauche).
Dans le domaine du vivant, la chiralité prend une très grande importance : prenons l’exemple de la carvone (C10H14O), une molécule qui existe sous forme de deux énantiomères dans la nature. La L-carvone a une odeur de menthe verte, tandis que la D-carvone a une odeur d’aneth et de carvi. Le fait est que nos récepteurs olfactifs sont sensibles à la chiralité des molécules. Idem pour le goût : dans le cas de l’aspartame, une forme est sucrée, tandis que l’autre est amère.
Si une molécule chirale entre dans la composition d’un médicament, l’un des énantiomères peut être efficace sur l’organisme, tandis que son binôme ne l’est pas, voire s’avère néfaste. Les exemples sont nombreux : l’une des deux formes de l’adrénaline est douze fois plus active que l’autre et une seule des deux formes de l’ibuprofène est active ! Plus grave : les malformations survenues à la fin des années 1950 sur des enfants dont les mères avaient été traitées à la thalidomide pendant leur grossesse étaient dues à l’un des deux énantiomères de la molécule ; l’autre présentait pourtant les propriétés sédatives attendues. Mais à l’époque, on utilisait le mélange des deux formes…
Le Dr Jeffery Huang Zhifeng, professeur agrégé au Département de physique de HKBU, et son équipe de recherche, ont trouvé le moyen de manipuler la chiralité moléculaire, éliminant ainsi les effets secondaires possibles qui peuvent survenir lorsque l’on ingère des médicaments contenant les « mauvais » énantiomères.
Une méthode macroscopique pour manipuler l’infiniment petit
Plus de la moitié des médicaments thérapeutiques sont constitués de quantités égales des deux énantiomères d’un composé chiral ; ces mélanges en proportions égales sont appelés des racémates. La production de molécules constituées uniquement de l’énantiomère « efficace » permettrait de produire des médicaments plus fiables et plus efficaces.
Or, les molécules ont une taille infime, allant d’un millionième à cent millièmes du diamètre d’un cheveu humain ! Il est donc extrêmement difficile de produire sélectivement l’un des deux énantiomères en utilisant un contrôle à l’échelle macroscopique (c’est-à-dire à une échelle qui peut être vue à l’œil nu et opérée à la main). Ainsi, pour produire des médicaments à énantiomère unique, les chimistes utilisent un processus appelé synthèse asymétrique, à partir de ligands chiraux. Cependant, ces technologies impliquent des procédures compliquées, coûteuses et peu respectueuses de l’environnement.
Huang et son équipe ont développé une nouvelle approche, permettant d’agir sur la chiralité des molécules à macro-échelle : ils utilisent un dispositif de fabrication de nanostructures métalliques hélicoïdales – de la taille d’un millième de diamètre de cheveu humain – qui leur permet de contrôler directement la direction de rotation d’un substrat. Ces nanohélices métalliques sont fabriquées par glancing angle deposition (GLAD) : de l’argent et du cuivre sont déposés sur un substrat de support, tourné dans le sens horaire et antihoraire, de manière à générer des nanohélices orientées vers la droite et vers la gauche.

Sur le même sujet : La prise prolongée de médicaments antiacides augmenterait significativement le risque de cancer de l’estomac
Les chercheurs ont ensuite provoqué une réaction chimique par UV, entre ces nanohélices et des molécules d’acide 2-anthracène carboxylique (AC). Ces dernières ont réagi avec les nanohélices pour former des produits moléculaires chiraux, similaires à certains médicaments. Lorsque l’AC était lié aux nanohélices « droites », puis exposé à la lumière ultraviolette, la réaction produisait majoritairement des énantiomères R. Inversement, lorsque l’AC était adsorbé sur la surface des nanohélices « gauches », puis exposé aux UV, les chercheurs obtenaient une majorité d’énantiomères S. En d’autres termes, ils sont parvenus à déterminer de manière fiable la chiralité du produit moléculaire à partir du sens des nanohélices métalliques utilisées.
L’avantage de cette technique par rapport à la méthode conventionnelle de synthèse asymétrique est que les nanohélices métalliques peuvent être utilisées à plusieurs reprises pour produire des médicaments à énantiomère unique, et sans utiliser de ligands chiraux. Par conséquent, la méthode développée par le laboratoire de Huang ouvre la voie à une production de masse de médicaments thérapeutiques au coût réduit et bien plus respectueuse de l’environnement.


