Malgré les avancées des stratégies thérapeutiques pour traiter le diabète de type 1 (DT1), l’administration exogène d’insuline reste le lot quotidien de la grande majorité des patients. En effet, s’il est désormais possible de restaurer la production de l’hormone par le biais de la transplantation, son application clinique généralisée comporte de nombreux défis. Les récentes approches pharmacologiques visant à régénérer les cellules β pancréatiques pourraient changer la donne. Nous avons interrogé un expert dans l’espoir de savoir si cette stratégie pourrait véritablement être disponible dans un avenir relativement proche.
Le diabète de type 1 (DT1), ou diabète insulinodépendant, est caractérisé par la destruction auto-immune et irréversible des cellules bêta pancréatiques, responsables de la synthèse, de la libération et du stockage de l’insuline. Ces cellules représentent environ 50 à 70 % de la masse cellulaire totale des îlots du pancréas humain. Si les symptômes n’apparaissent généralement pas avant la perte de 80 % des cellules bêta, la dérégulation de la glycémie entraîne sur le long terme de multiples complications, telles que la néphropathie diabétique, la neuropathie, la rétinopathie, la cataracte et les maladies cardiovasculaires.
On estime qu’environ 8,42 millions de personnes souffraient de DT1 dans le monde en 2021, avec près de 510 000 nouveaux cas chaque année. 60 % des cas sont concentrés au niveau des 10 pays à plus forte prévalence au monde, incluant les États-Unis, l’Inde, le Brésil, la Chine, l’Allemagne, le Royaume-Uni, la Russie, le Canada, l’Arabie Saoudite et l’Espagne. Une récente modélisation suggère que la prévalence annuelle de la maladie pourrait atteindre entre 13,5 et 17,4 millions d’ici 2040 et que la plus forte augmentation serait observée au niveau des pays à revenus faible et moyen.
Des doses d’insuline hors de prix
La perte des cellules bêta implique que les patients souffrant de DT1 doivent quotidiennement surveiller leur glycémie et compenser leur déficit en insuline afin de maintenir un taux proche de la normale. Pour ce faire, les traitements de première intention consistent généralement en des injections quotidiennes d’insuline. Les médicaments insulinotropes (stimulant la production d’insuline) peuvent aussi être prescrits dans certains cas.
« Les personnes atteintes de diabète de type 1 dépendent de l’insuline injectée ou pompée pour le reste de leur vie pour réguler leur glycémie », confirme dans un e-mail à Trust My Science Assam El-Osta, éminent épigénétiste du Baker Heart and Diabetes Institute et de l’Université de Monash (en Australie). Cependant, « même si les approches thérapeutiques actuelles contre le diabète de type 1 sauvent des vies, on estime actuellement que moins d’un patient sur cinq parvient à véritablement contrôler sa glycémie par l’injection d’insuline », a-t-il ajouté en répondant à nos questions.
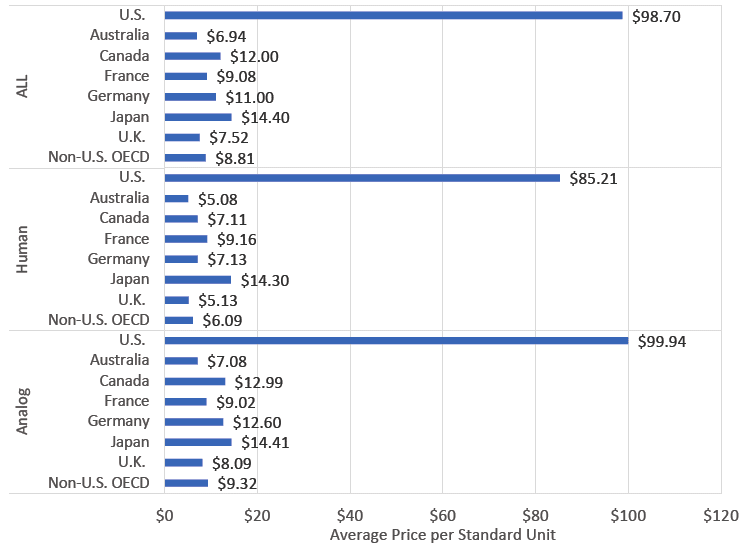
De plus, les doses d’insuline sont non seulement hors de prix, mais également indisponibles dans de nombreuses régions du monde en raison du manque d’approvisionnement. En 2020, le prix moyen par dose aux États-Unis (tout type d’insuline confondu) était de 98,70 dollars, contre 12 dollars et 9,08 dollars au Canada et en France respectivement.
D’autre part, un contrôle métabolique plus renforcé (par le biais de l’insulinothérapie intensive par exemple) permet de prévenir ou de réduire l’incidence des complications secondaires liées à la maladie. Toutefois, il présente tout de même des risques élevés d’hypoglycémie et de prise de poids. En outre, bien que ces techniques permettent de stabiliser la glycémie, elles ne permettent cependant pas d’inverser ou de ralentir la destruction des cellules bêta.
La transplantation d’îlots est confrontée à de nombreuses limitations
Les traitements actuels les plus avancés visant à rétablir les fonctions des cellules bêta consistent soit en la transplantation du pancréas entier, soit en la transplantation d’îlots pancréatiques (ou îlots de Langerhans) — une procédure relativement moins invasive que la première. Contrairement aux stratégies précédentes, visant uniquement à maintenir une glycémie proche de la normale, la transplantation vise à restaurer la normoglycémie en rétablissant la sécrétion endogène et régulée d’insuline et d’autres hormones produites par les îlots de Langerhans.
Un taux de réussite de 90 % en matière de fonctionnalité à un an des allogreffes d’îlots a été rapporté par divers centres de santé au cours des deux dernières décennies. Cependant, cette alternative se heurte à d’importants défis quant à son application généralisée. En effet, la transplantation d’îlots pancréatiques consiste à isoler les greffons provenant du pancréas d’un donneur décédé, puis à les injecter via la veine porte sous immunosuppression. Bien que dans certains cas des îlots aient été prélevés auprès de donneurs vivants (par pancréactomie partielle), le taux de complication postopératoire est si élevé que cette méthode n’est choisie que très rarement.

Traduction des principaux encadrés :
- Découverte de l’insuline
- Injection d’insuline multiquotidienne
- Perfusion sous-cutanée continue d’insuline (pompe)
- (en haut) Remplacement de cellules bêta par transplantation
- (en bas) Régénération de cellules bêta
D’autre part, « bien que leur utilité clinique ait été prouvée, ces thérapies sont confrontées à la dure réalité de la pénurie de donneurs ainsi qu’aux effets secondaires associés des médicaments immunosuppresseurs », explique El-Osta à Trust My Science. En effet, l’indépendance insulinique nécessite jusqu’à 2 à 3 perfusions, avec un objectif de 9000 îlots par kilogramme de poids corporel du receveur. Environ 3 pancréas sont nécessaires pour générer suffisamment d’îlots pour une transplantation chez un seul receveur. D’autre part, les coûts de l’intervention (qui n’est effectuée que par quelques établissements spécialisés dans le monde), de l’isolation des îlots jusqu’à la transplantation et les suivis postopératoires, sont considérables.
Afin de surmonter ces défis, différentes sources potentielles visant à produire des cellules bêta en grande quantité sont étudiées. Les cellules sont par exemple produites à partir de la différenciation de cellules souches pluripotentes humaines ou embryonnaires. Différentes molécules, dont des facteurs de croissance et de transcription solubles, ont été utilisées à cette fin. Toutefois, la mauvaise reproductibilité des protocoles de différenciation constitue un défi majeur. En effet, les tentatives de régénération étaient jusqu’à présent relativement hasardeuses.
Des médicaments régénérateurs déjà approuvés par la FDA
En vue des difficultés liées aux précédentes stratégies, il existe un besoin urgent d’identifier de nouveaux traitements stimulant la croissance et restaurant les fonctions des cellules bêta. Dans cette vision, des approches pharmacologiques sont depuis peu explorées pour la réactivation ou la régénération in situ de ces cellules.