Une étude vient de dévoiler un lien entre le régime alimentaire des mères et la santé neuronale des petits-enfants. Cette recherche identifie la molécule sphingosine-1-phosphate (S1P) comme un acteur clé dans cette transmission intergénérationnelle. Les implications sont vastes, suggérant que nos choix alimentaires peuvent fortement influencer la santé des générations futures, bien au-delà de nos propres vies.
L’alimentation est un pilier fondamental de notre bien-être, son rôle sur notre santé immédiate étant bien connu. Cependant, son influence sur les générations à venir reste un terrain largement inexploré. Une étude récente menée par l’Université Monash (Australie) s’est penchée sur cette question, mettant en avant le lien entre le régime alimentaire des mères et la santé neuronale de leurs descendants.
En se focalisant sur des molécules spécifiques, cette recherche apporte un éclairage inédit sur la transmission intergénérationnelle de traits physiologiques. Les résultats sont publiés dans la revue Nature Cell Biology.
Le rôle des sphingolipides
Au cœur de cette découverte se trouve une molécule appelée sphingosine-1-phosphate (S1P). Localisée dans l’intestin, elle joue un rôle crucial dans la transmission d’informations génétiques aux ovules. En d’autres termes, elle est capable d’influencer le métabolisme des sphingolipides, des composants essentiels des membranes cellulaires, pour les générations à venir.
Pour étudier ce phénomène en profondeur, les chercheurs ont choisi le ver Caenorhabditis elegans comme modèle. Ce choix n’est pas anodin. En effet, C. elegans est un organisme modèle largement utilisé en biologie en raison de sa simplicité, de sa courte durée de vie et de sa transparence, ce qui facilite l’observation sous microscope. De plus, bien que simple, il partage de nombreux processus biologiques avec les êtres humains, ce qui rend ses réactions pertinentes pour une extrapolation plus large.
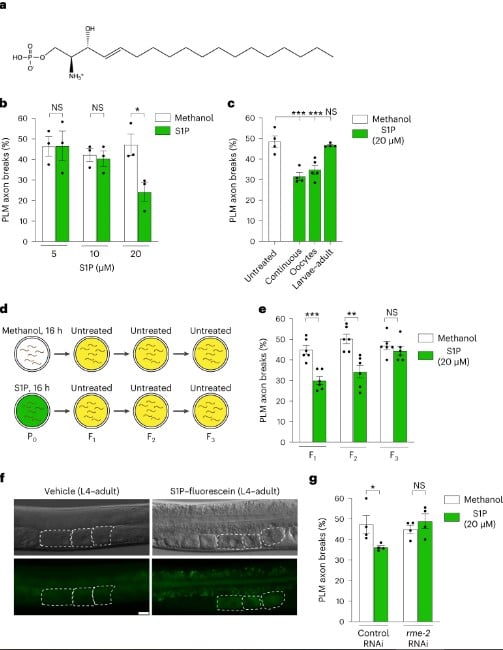
En utilisant ce modèle, les scientifiques ont pu observer comment la S1P agit pour protéger les neurones. Ils ont découvert que cette molécule joue un rôle protecteur contre la fragilité des axones, les prolongements des neurones responsables de la transmission de l’information nerveuse. Cette découverte suggère que l’intégrité neuronale pourrait être influencée par des facteurs environnementaux et alimentaires transmis à travers les générations via la S1P.
L’importance de l’acide ursolique
Un autre élément clé de cette étude est l’acide ursolique (UA). C’est une molécule naturellement présente dans plusieurs plantes et fruits, notamment dans les pommes et les herbes (basilic, romarin, thym, origan et sauge). Elle est reconnue pour ses propriétés anti-inflammatoires et antioxydantes.
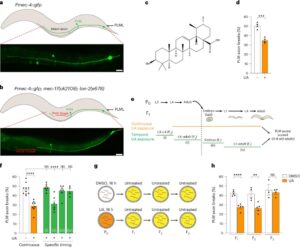
Lorsque l’UA est introduit pendant la phase de production d’ovules chez le ver C. elegans, il a été observé qu’il exerce un effet bénéfique sur le transport axonal. Le transport axonal est un processus essentiel qui permet le déplacement des molécules, des organites et des vésicules le long des axones. Une perturbation de ce mécanisme peut entraîner des maladies neurodégénératives.
Grâce à l’UA, non seulement le transport axonal est favorisé, mais la fragilité des axones est également réduite. Cela signifie que les axones sont moins susceptibles de se rompre ou de subir des dommages, assurant ainsi une meilleure transmission de l’information nerveuse.
Mais comment l’UA parvient-il à exercer cet effet protecteur ? La réponse réside dans son interaction avec les sphingolipides. L’UA stimule l’expression d’une enzyme spécifique dans l’intestin, responsable de la biosynthèse des sphingolipides. Ces lipides jouent un rôle crucial dans la structure et la fonction des membranes cellulaires, notamment dans le système nerveux.
Le lien entre l’intestin et la neuroprotection est établi par le transport de la S1P du tube digestif à l’ovule. Ce mécanisme est essentiel pour assurer la transmission des bénéfices neuroprotecteurs à la génération suivante. En d’autres termes, l’UA, en modulant le métabolisme des sphingolipides dans l’intestin, permet à la S1P de jouer son rôle protecteur, garantissant ainsi la santé neuronale des générations futures.
Une nouvelle perspective sur la santé neuronale
Les récentes découvertes renforcent l’idée que la nutrition est un élément clé de la santé globale, avec des implications qui s’étendent bien au-delà de la génération actuelle. En effet, la mise en évidence du rôle de la S1P et de l’UA dans la protection neuronale intergénérationnelle met en lumière la profonde influence que peuvent avoir les facteurs environnementaux et alimentaires sur la transmission de traits biologiques spécifiques.
Cependant, bien que ces découvertes soient prometteuses, il convient de les aborder avec prudence. Le ver C. elegans, bien qu’utile comme modèle biologique, présente des différences significatives avec les mammifères. Il est donc crucial de poursuivre les recherches pour explorer si ces mécanismes observés chez le ver sont également présents chez d’autres espèces.
L’auteur principal, le professeur Roger Pocock, conclut dans un communiqué : « Le régime alimentaire d’une mère peut affecter non seulement le cerveau de sa progéniture, mais potentiellement les générations suivantes. Notre travail soutient une alimentation saine pendant la grossesse ».


