La maladie de Lyme est transmise lors d’une piqûre de tique infectée par des bactéries nommées « boréllies » (Borrelia garinii, B. afzeli, B. burgdorferi, etc.). Même après des semaines de traitements antibiotiques, certaines personnes atteintes de la maladie continuent à présenter des symptômes, parfois invalidants. De nouveaux travaux suggèrent que des fragments morts de Borrelia burgdorferi persisteraient dans l’organisme et continueraient à provoquer une inflammation dans les systèmes nerveux central et périphérique.
Transmise par l’intermédiaire d’une tique infectée par la bactérie Borrelia, la maladie de Lyme est la principale pathologie à transmission vectorielle aux États-Unis et dans l’hémisphère nord. La piqûre de tique est le plus souvent suivie de l’apparition d’une éruption cutanée appelée « érythème migrant », accompagnée de fièvre, de maux de tête et de malaise. D’autres organes peuvent être touchés comme le cœur, les articulations et les systèmes nerveux central et périphérique.
Dans la plupart des cas et lorsqu’elle est diagnostiquée tôt, la maladie de Lyme précoce est traitée (avec succès) par des antibiotiques. Toutefois, environ 10 à 35% des patients traités pour un érythème migrant ou une maladie de Lyme précoce présentent des symptômes persistants (souvent sur 6 à 12 mois de suivi). Ces personnes ressentent des douleurs, de la fatigue et des troubles de la pensée cognitive, affection connue sous le nom de syndrome de la maladie de Lyme après traitement (SPTML).
Dans des études précédentes, les chercheurs de l’université Tulane en Louisiane avaient montré que Borrelia burgdorferi non viable pouvait induire une neuroinflammation (inflammation dans le système nerveux) et une apoptose — ou mort cellulaire programmée — dans une lignée cellulaire d’oligodendrocytes, utiles au système nerveux central. Dans cette étude de suivi, ils ont analysé l’effet de restes de B. burgdorferi sur deux types d’explants de macaques : le cortex frontal du cerveau (système nerveux central) et le ganglion de la racine dorsale de la colonne vertébrale (système nerveux périphérique). Les bactéries vivantes et le milieu seul ont respectivement servi de contrôle positif et négatif.
Davantage de marqueurs inflammatoires induits par les bactéries non viables
Comme les bactéries vivantes, B. burgdorferi non viable a induit des niveaux significatifs de plusieurs médiateurs inflammatoires dans le cortex frontal et dans le ganglion de la racine dorsale. Cependant, les chercheurs ont constaté que les marqueurs inflammatoires étaient plusieurs fois plus élevés dans les échantillons exposés à B. burgdorferi non viable que dans ceux exposés à des bactéries vivantes, en particulier pour les marqueurs IL-6, CXCL8 et CCL2.
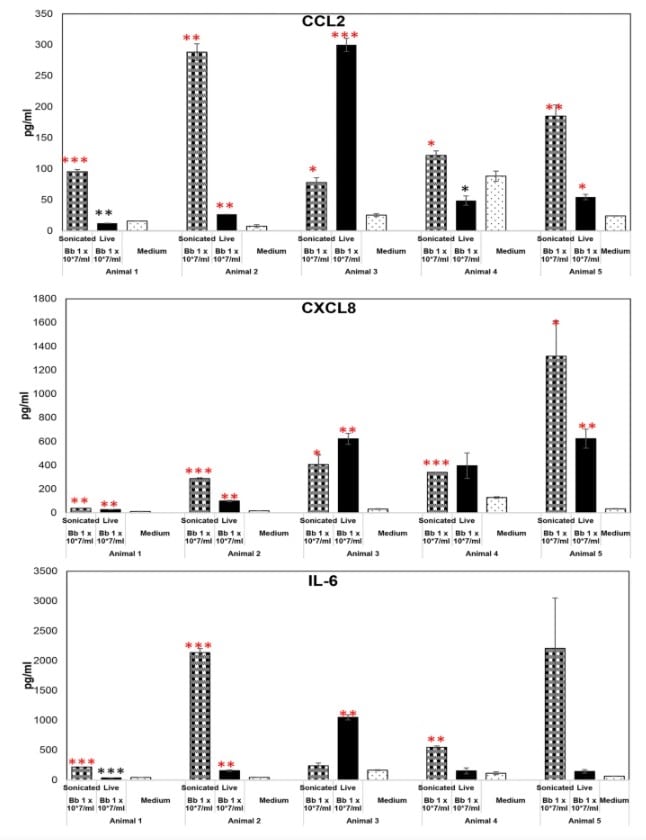
En outre, les bactéries mortes ont aussi provoqué la mort cellulaire des neurones du cerveau : les restes de B. burgdorferi ont induit des niveaux significatifs d’apoptose dans le cortex frontal et dans le ganglion de la racine dorsale. L’apoptose était limitée à certaines cellules dans le ganglion, tandis qu’une apoptose neuronale distincte a également été détectée dans la plupart des tissus du cortex frontal. Ce dernier aide à coordonner les mouvements, organiser les pensées et contrôler la mémoire de travail. Il s’agit là d’une découverte intéressante pour connaître l’origine du SPTML.
« La neuroinflammation étant à la base de nombreux troubles neurologiques, une inflammation persistante dans le cerveau due à ces fragments non résolus pourrait avoir des conséquences à long terme sur la santé », explique l’immunologiste Geetha Parthasarathy.
« La persistance des symptômes chez certains patients après le traitement indique que dans un sous-ensemble de ces patients, des fragments de B. burgdorferi dans le système nerveux pourraient être une cause », écrivent les chercheurs. Reste à savoir pourquoi l’organisme de ces patients n’élimine pas les bactéries non viables après le traitement. De nouvelles connaissances sur le sujet pourraient également permettre de développer des médicaments capables de cibler ces restes et de soulager les symptômes du SPTML.