En 1825, le physicien et chimiste britannique Michael Faraday isole un composé particulier dans le liquide résiduel présent dans le fond des bouteilles d’éclairage : le benzène. Suggérée dès 1861, la structure chimique du benzène est décrite correctement en 1933 par Linus Pauling. Cependant, depuis sa découverte, les chimistes se sont toujours questionnés sur sa structure électronique extrêmement complexe. Et récemment, une équipe de chercheurs l’a enfin décrite en détail.
Près de 200 ans après la découverte de la molécule par Michael Faraday, les chercheurs ont enfin révélé la structure électronique complexe du benzène. Cette découverte a des implications importantes pour le développement futur de matériaux optoélectroniques, dont beaucoup sont basés sur des benzènes. L’étude a été publiée dans la revue Nature Communications.
La structure atomique du benzène est assez bien comprise. C’est un cycle composé de six atomes de carbone et de six atomes d’hydrogène, chacun rattaché à un atome de carbone.
Benzène : une structure de 42 électrons décrite en 126 dimensions
Là où la chose se complique, c’est lorsqu’il s’agit de considérer les 42 électrons de la molécule. « La fonction mathématique qui décrit les électrons du benzène est à 126 dimensions. Cela signifie que c’est une fonction de 126 coordonnées, trois pour chacun des 42 électrons. Les électrons ne sont pas indépendants, nous ne pouvons donc pas la décomposer en 42 fonctions tridimensionnelles indépendantes », explique le chimiste Timothy Schmidt, de l’ARC Centre of Excellence in Exciton Science, en Australie.
« Le résultat calculé par un ordinateur n’est pas facile à interpréter par un humain, et nous avons dû trouver un moyen d’accéder à ce résultat ».
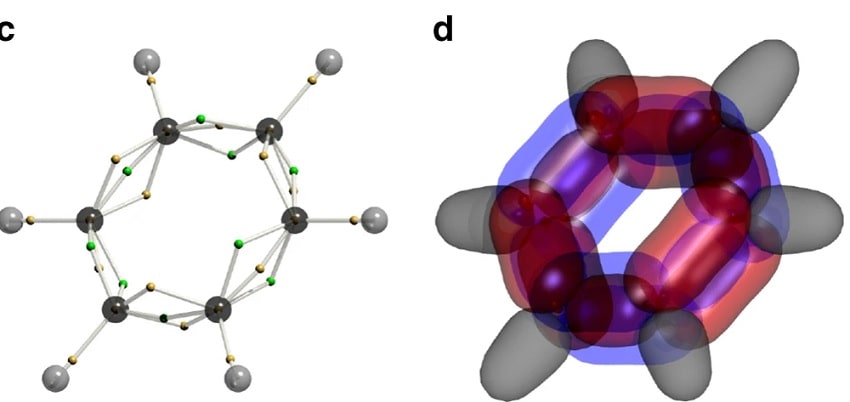
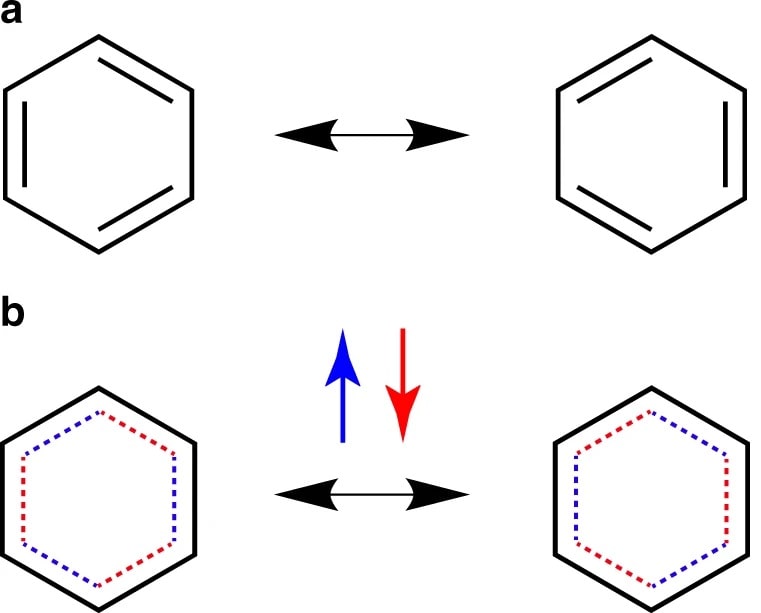
Cela signifie donc que la description mathématique de la structure électronique du benzène doit prendre en compte 126 dimensions. Cette complexité est la raison pour laquelle la révélation de la structure est restée un problème pendant si longtemps, conduisant à des débats sur le comportement des électrons du benzène. Il existe deux écoles de pensée : le benzène suit la théorie des liaisons de valence, avec des électrons localisés ; ou la théorie orbitale moléculaire, avec des électrons délocalisés.
Sur le même sujet : À l’état liquide, les molécules d’eau possèdent en réalité deux structures différentes
Une dynamique électronique bien plus complexe que prévu
Le problème est que ni l’une ni l’autre des théories ne semble vraiment correspondre. « L’interprétation de la structure électronique en termes d’orbitales ignore que la fonction d’onde est antisymétrique lors de l’échange de spins similaires. En outre, les orbitales moléculaires ne fournissent pas une description intuitive de la corrélation électronique », écrivent les chercheurs.
Le travail de l’équipe est basé sur une technique récemment développée appelée échantillonnage dynamique de Voronoi Metropolis, qui utilise une approche algorithmique pour visualiser les fonctions d’onde d’un système à électrons multiples. Cela sépare les dimensions des électrons en tuiles séparées dans un diagramme de Voronoi, chacune des tuiles correspondant aux coordonnées des électrons, permettant à l’équipe de cartographier la fonction d’onde des 126 dimensions. Et ils ont alors découvert quelque chose d’étrange…
« Les électrons avec un spin haut à double liaison étaient ceux avec un spin bas à simple liaison, et vice versa. Ce n’est pas ainsi que les chimistes décrivent habituellement le benzène. Cela a pour effet que les électrons s’évitent mutuellement quand la situation le nécessite, réduisant l’énergie de la molécule et la rendant plus stable », conclut Schmidt.
En d’autres termes, ce résultat décrit le principal effet de la corrélation électronique dans le benzène, et souligne que les électrons ne sont pas appariés dans l’espace lorsque c’est énergétiquement avantageux.


 L’électron est une particule élémentaire qui, avec les protons et
les neutrons, constitue les atomes. C’est donc l’un des composants
principaux de la matière baryonique. À ce titre, il revêt... [...]
L’électron est une particule élémentaire qui, avec les protons et
les neutrons, constitue les atomes. C’est donc l’un des composants
principaux de la matière baryonique. À ce titre, il revêt... [...]