Une équipe de l’Université de Pittsburgh a mis au point une nouvelle approche permettant de stimuler la moelle épinière et d’améliorer instantanément la mobilité des bras et des mains chez les personnes victimes d’un accident vasculaire cérébral (AVC). Testée sur deux patientes, cette approche a eu des résultats très encourageants et apparaît aujourd’hui comme une voie prometteuse pour améliorer et accélérer la récupération post-AVC.
L’accident vasculaire cérébral (AVC) survient de façon très brutale ; il résulte dans 85% des cas de la formation d’un caillot dans un vaisseau cérébral, qui bloque momentanément l’irrigation sanguine et l’oxygénation. On parle d’AVC « ischémique ». Les 15% restants sont des AVC « hémorragiques », provoqués par la rupture d’une artère cérébrale. En France, on estime que 140 000 personnes par an sont victimes d’un AVC. Plus d’un tiers de ces attaques cérébrales entraînent d’importantes séquelles, telles que des déficits moteurs, des pertes de sensibilité ou des troubles du langage.
L’AVC est aujourd’hui la première cause de handicap acquis de l’adulte. Ces accidents vasculaires peuvent notamment perturber les commandes descendantes des zones corticales motrices vers la moelle épinière, ce qui peut entraîner des déficits moteurs permanents du bras et de la main. Des chercheurs de l’Université de Pittsburgh et de l’Université Carnegie Mellon expliquent toutefois que, sous la lésion, les circuits spinaux qui contrôlent le mouvement, eux, restent intacts. Ils ont donc tenté de cibler directement ces circuits pour restaurer le mouvement.
Des mouvements retrouvés après plusieurs années de paralysie
Les experts estiment qu’au niveau mondial, un individu sur quatre âgé de plus de 25 ans sera victime d’un AVC au cours de sa vie. Les trois-quarts d’entre eux présenteront des déficits durables du contrôle moteur de leur bras et de leur main, ce qui, en dehors de l’impact social et professionnel, nuit considérablement à la qualité de vie du malade — les déficiences motrices du bras et de la main étant particulièrement éprouvantes et entravant les activités quotidiennes les plus simples.
Il est donc urgent de développer des solutions efficaces pour restaurer le mouvement des membres supérieurs chez les personnes victimes d’AVC. Des approches de stimulation de la moelle épinière ont déjà fait leurs preuves pour traiter les douleurs chroniques et pour rétablir le mouvement des jambes après une lésion médullaire. Mais il n’est pas si simple de transposer cette approche pour traiter le déficit moteur des membres supérieurs résultant d’un AVC ; la dextérité de la main humaine, combinée à la grande amplitude de mouvement du bras et à la complexité des signaux neuronaux qui contrôlent le bras et la main, pose en effet de nombreux défis.
Grâce à diverses modélisations informatiques et à des tests sur des macaques atteints de paralysie partielle du bras, les chercheurs ont toutefois réussi à développer une nouvelle technique très prometteuse. « Les nerfs sensoriels du bras et de la main envoient des signaux aux motoneurones de la moelle épinière qui contrôlent les muscles du membre. En stimulant ces nerfs sensoriels, nous pouvons amplifier l’activité des muscles qui ont été affaiblis par un AVC », explique le Dr Douglas Weber, professeur de génie mécanique à l’Institut des neurosciences de l’Université Carnegie Mellon et co-auteur de l’étude décrivant cette nouvelle approche.
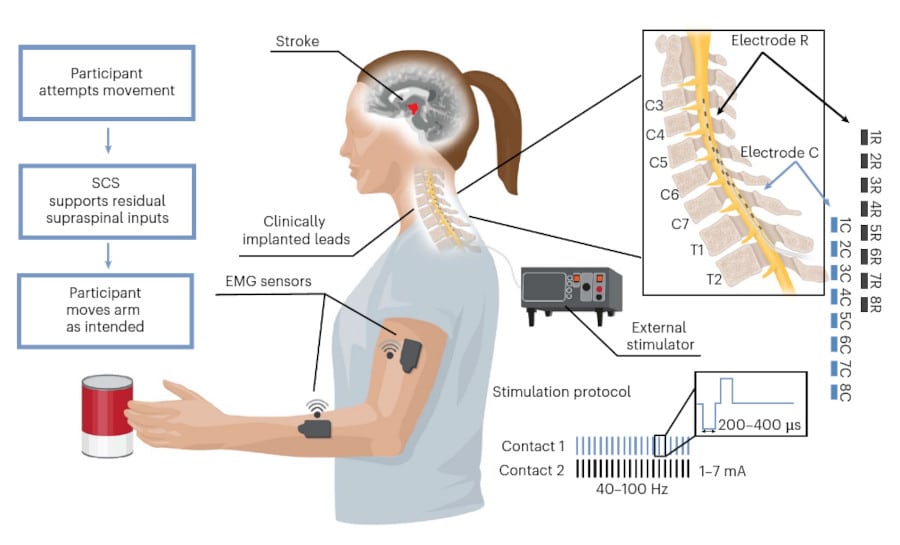
Dans le cadre d’une première expérience sur l’homme, leur approche a été testée sur deux participantes. Leurs racines nerveuses cervicales ont été stimulées pendant 29 jours grâce à une paire de fines électrodes implantées dans la moelle épinière, pour augmenter l’excitation des motoneurones du bras et de la main. L’une des deux participantes à l’essai, Heather Rendulic, ne pouvait plus bouger son bras et sa main gauche depuis plus de neuf ans. Le premier jour où l’implant a été mis en place, elle a enfin pu ouvrir et fermer sa main.
Un effet qui persiste même après désactivation de la stimulation
L’équipe rapporte que cette stimulation continue a amélioré la force (+40% de force de préhension pour la patiente 1 et +108% pour la patiente 2) et la vitesse (+30% à +40%) des mouvements chez les deux patientes, qui ont pu réaliser des mouvements qu’elles ne pouvaient plus effectuer avant cette stimulation. Elles ont notamment été capables d’ouvrir et de fermer complètement le poing, de lever le bras au-dessus de la tête, de saisir et déplacer des objets du quotidien, ou encore d’ouvrir une serrure.
À noter que les patientes gardent ici un contrôle total de leurs mouvements : la stimulation est assistée et renforce l’activation musculaire uniquement lorsqu’elles décident de bouger, précise le Dr Weber. En plus de restaurer le mouvement, l’appareil semble permettre aux patients de retrouver la sensation de l’endroit où se trouvent leurs bras dans l’espace, améliorant ainsi leur contrôle moteur, a ajouté la Dre Elvira Pirondini, professeure adjointe de médecine physique et de réadaptation à l’Université de Pittsburgh et co-auteure de l’étude.
Contre toute attente, les chercheurs ont également remarqué que les effets de la stimulation persistaient plus longtemps que prévu, jusqu’à quatre semaines après le retrait du dispositif. « Les deux participants ont conservé certaines de ces améliorations même sans stimulation et aucun événement indésirable grave n’a été signalé », écrivent les auteurs de l’étude. En d’autres termes, cela signifie que cette stimulation pourrait être utilisée ponctuellement comme « entraînement physique », conduisant à des améliorations à long terme.
Les tests effectués n’impliquant que deux personnes, l’équipe ne peut évaluer de manière concluante la sécurité et l’efficacité du dispositif. Néanmoins, les résultats sont très prometteurs et l’approche repose sur des technologies cliniques existantes approuvées par la FDA, ce qui devrait permettre de déployer rapidement cette approche une fois qu’elle aura été testée plus avant. À présent, les chercheurs vont recruter d’autres patients afin d’optimiser les protocoles de stimulation selon différents niveaux de gravité de la paralysie.


