Une équipe de recherche a identifié un fragment de protéine clé qui, d’une pierre deux coups, active sélectivement l’autodestruction des cellules cancéreuses et améliore l’efficacité de l’immunothérapie CAR-T pour les tumeurs solides. En effet, le microenvironnement et l’hétérogénéité de ces dernières ont tendance à empêcher les cellules CAR-T de les infiltrer suffisamment pour la destruction. L’identification de la nouvelle cible thérapeutique offre une voie prometteuse pour contourner cet obstacle.
Les tumeurs solides sont généralement traitées par chirurgie, suivie d’une chimiothérapie ou d’une radiothérapie. Cependant, ces traitements ne permettent souvent que des rémissions temporaires et les tumeurs peuvent recroître plus tard. Les immunothérapies telles que CAR-T se sont montrées prometteuses pour une rémission prolongée, mais ne peuvent malheureusement aider qu’un nombre très restreint de patients.
La thérapie CART-T consiste à modifier génétiquement les lymphocytes T du patient, de sorte à reconnaître et à éliminer les tumeurs. Alors que la thérapie a montré une certaine efficacité pour traiter la leucémie et d’autres cancers du sang, elle peine considérablement à freiner la progression des tumeurs solides. La raison est que ces derniers possèdent un microenvironnement hautement immunosuppresseur, entravant l’infiltration des cellules T. « On les appelle souvent tumeurs froides, parce que les cellules immunitaires ne peuvent tout simplement pas pénétrer dans les microenvironnements pour produire un effet thérapeutique », explique le coauteur de la nouvelle étude, Jogender Tushir-Singh, de l’Université de Californie à Davis. D’autre part, certaines tumeurs sont génétiquement hétérogènes et contiennent plusieurs types de cellules, chacun réagissant différemment au traitement.
Afin de contourner ces obstacles, Tushir-Singh et ses collègues se sont tournés vers les récepteurs proapoptotiques — notamment le CD95 — activant la mort cellulaire programmée, ou FAS (Fibroblast Activated Sequence). En effet, le ciblage de ces récepteurs a le potentiel d’activer à la fois l’autodestruction des cellules tumorales et de dégager la voie pour faciliter l’infiltration des cellules CAR-T. « La façon dont nous concevons les anticorps activant les récepteurs immunitaires et les cellules T n’a pas d’importance s’ils ne peuvent pas se rapprocher des cellules tumorales. Par conséquent, nous devons créer des espaces pour que les cellules T puissent s’infiltrer », indique l’expert.
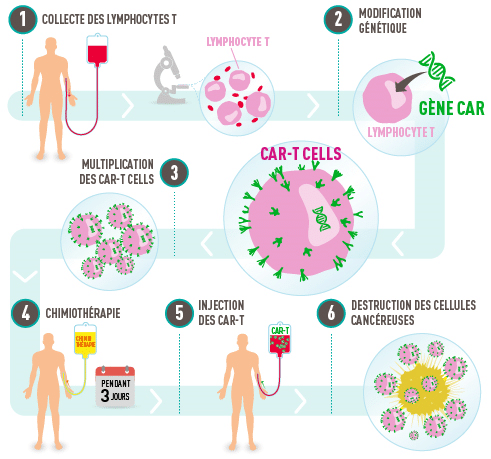
Une cible à double effet thérapeutique
Le récepteur Fas appartient, avec le Death Receptor-5 (DR5), à une superfamille de récepteurs alpha de nécrose tumorale. En se liant avec leurs anticorps d’activation (agonistes), ils enclenchent une signalisation apoptotique en rassemblant des complexes protéiniques transmembranaires. Si de nombreux essais cliniques ont été effectués pour le ciblage de DR5, le ciblage de FAS est beaucoup moins exploré.
Or, les niveaux de FAS sont particulièrement élevés dans les tumeurs solides, dont celles affectant les ovaires. En outre, la signalisation FAS est essentielle au maintien de l’élimination des cellules tumorales par les lymphocytes T et d’une homéostasie immunitaire saine.
De précédentes recherches ont démontré que la signalisation FAS est déterminante pour le succès de la thérapie CAR-T, en particulier pour les tumeurs génétiquement hétérogènes. Cela signifierait qu’un agoniste Fas pourrait améliorer la thérapie CAR-T, de sorte qu’elle puisse éliminer les cellules tumorales dépourvues des antigènes qu’elle est censée cibler. Cependant, « les efforts précédents pour cibler ce récepteur ont échoué. Mais maintenant que nous avons identifié cet épitope, il pourrait y avoir une voie thérapeutique pour cibler FAS dans les tumeurs », suggère Tushir-Singh.
Dans le cadre de leur nouvelle étude, Tushir-Singh et ses collègues ont exploré l’hypothèse selon laquelle les cellules cancéreuses pourraient être ciblées de manière beaucoup plus sélective, en identifiant le bon épitope critique FAS (un fragment protéinique du récepteur). « Il est impératif de découvrir l’épitope de ciblage le plus critique et le plus régulateur du récepteur FAS pour la prochaine génération de produits immunothérapeutiques capables de cibler sélectivement les tumeurs », indiquent-ils dans leur document d’étude, publié dans la revue Cell Death & Differentiation. En d’autres termes, cet épitope agirait tel un interrupteur, activé par un anticorps qui s’y lie spécifiquement.
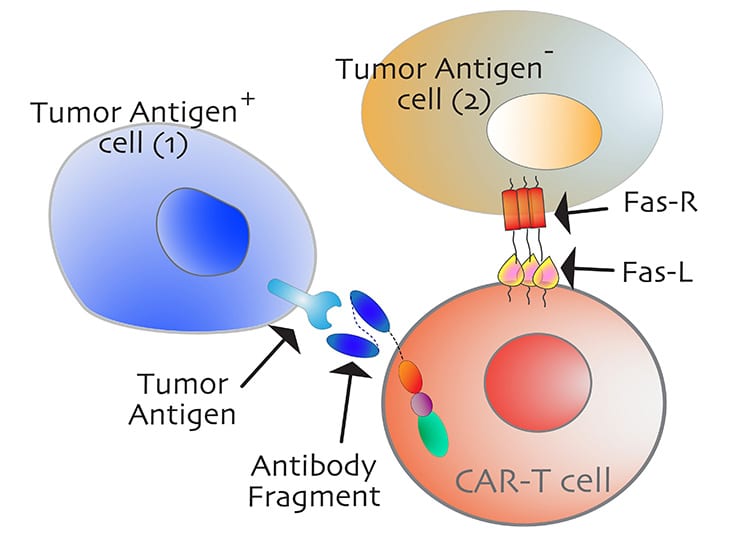
Dans cette vision, les chercheurs ont analysé des modèles de lignées cellulaires tumorales ovariennes humaines et animales. Ils ont notamment cherché à déterminer si, à l’instar de celle du récepteur DR5, la voie FAS exploite un motif régulateur d’un épitope dit « de résidu chargé positivement » (PPCR), pour regrouper les récepteurs transmembranaires et les activer de manière optimale. C’est-à-dire que l’engagement de l’épitope PPCR est essentiel pour maximiser la signalisation de l’agoniste FAS.
Après analyse, l’équipe a identifié un fragment critique PPCR de FAS au niveau d’une région riche en cystéine. Deux nouveaux anticorps se liant au fragment se sont montrés particulièrement efficaces pour enclencher efficacement l’apoptose des cellules tumorales, tout en ouvrant la voie aux cellules CAR-T. Il a également été constaté que les cellules comportant une version mutée de l’épitope ne répondaient pas du tout à la thérapie CAR-T. Cela signifie qu’avant l’administration de cette thérapie, le statut FAS des patients devrait être préalablement déterminé.