La mort des neurones spécialisés dans la synthèse de la dopamine, l’un des principaux neurotransmetteurs du cerveau, détériore les capacités motrices et cognitives des personnes atteintes de la maladie de Parkinson. La perte de ces neurones est liée à l’agrégation de l’alpha-synucléine. Des études récentes montrent que les oligomères, les agrégats initiaux de cette protéine, sont les formes les plus pathogènes de l’α-synucléine et sont responsables de la propagation de la maladie dans le cerveau. Dans ce cadre, une équipe internationale de chercheurs a identifié un peptide particulier empêchant l’agrégation de l’α-synucrkinsonléine.
Par conséquent, l’une des approches les plus prometteuses pour lutter contre ce trouble consiste à neutraliser ces oligomères et, ainsi, ralentir la progression pathologique. Cependant, le fait que ces agrégats ne présentent pas une structure définie et qu’ils soient de nature transitoire rend extrêmement difficile l’identification de molécules qui se lient avec une force suffisante pour explorer une quelconque application clinique.
Une collaboration scientifique entre des chercheurs de l’Institut de biotechnologie et de biomédecine (IBB) de l’Universitat Autònoma de Barcelona (UAB) et de l’Instituto de Biocomputación y Física de Sistemas Complejos (BIFI) de l’Universidad de Zaragoza (UniZar), a désormais pu identifier un peptide endogène humain qui se fixe fortement et spécifiquement sur les oligomères de l’α-synucléine, évitant ainsi leur agrégation et bloquant leur neurotoxicité, deux processus étroitement liés au déclin neurodégénératif de la maladie de Parkinson. L’identification et l’étude du peptide, appelé LL-37, ont été publiées dans la revue Nature Communications.
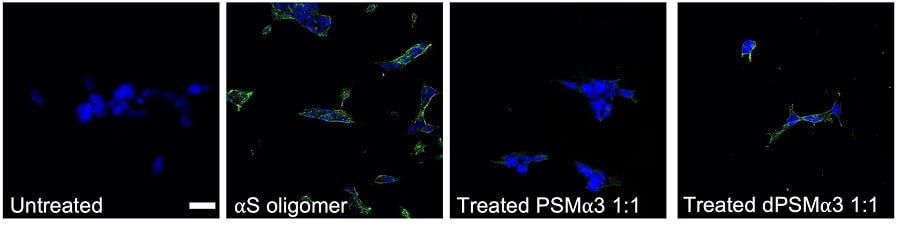
« Le LL-37 interagit avec les oligomères toxiques d’alpha-synucléine de manière sélective et avec une force supérieure à celle de tout peptide précédemment décrit, équivalente à la force présentée par les anticorps. Il inhibe l’agrégation à de très faibles concentrations et protège les cellules neuronales de l’endommagement », soulignent les chercheurs.
Un peptide déjà présent dans notre organisme
Ils ajoutent que « LL-37 se trouve naturellement dans l’organisme humain, à la fois dans le cerveau et dans l’intestin, organes dans lesquels l’agrégation de l’α-synucléine a lieu dans la maladie de Parkinson. Cela suggère que l’activité de LL-37 pourrait répondre à un mécanisme développé par le corps lui-même comme moyen de lutter naturellement contre cette maladie ».
Encouragés par cette idée, les chercheurs veulent maintenant étudier comment son expression peut être régulée et si cette stratégie peut devenir une thérapie sûre avec le potentiel d’influencer l’évolution de la maladie. « Il est possible qu’une thérapie pour la maladie de Parkinson se trouve déjà dans notre organisme et qu’elle ait seulement besoin d’être activée correctement », déclare Salvador Ventura, chercheur à l’IBB et coordinateur de l’étude.
Trois molécules aux propriétés anti-agrégation
L’identification de LL-37 a été menée dans le cadre d’une recherche analysant la structure et les caractéristiques d’oligomères pathogènes dans le but de les neutraliser de manière spécifique. Les analyses réalisées démontrent que les peptides hélicoïdaux avec un côté hydrophobe et un autre côté chargé positivement sont idéaux pour ce type d’activité.
Les essais ont permis aux chercheurs d’identifier trois molécules ayant une activité anti-agrégation : en plus de la molécule humaine, un deuxième peptide présent dans les bactéries et une troisième molécule fabriquée artificiellement ont été identifiés.
En plus de représenter une voie thérapeutique possible pour la maladie de Parkinson et d’autres pathologies de la synucléine, les molécules identifiées dans l’étude sont des outils prometteurs pour son diagnostic, étant donné qu’elles distinguent les espèces fonctionnelles et toxiques de l’α-synucléine.