Des chercheurs ont identifié un nouveau composé peptidique capable d’inhiber l’activité du MYC, une protéine particulièrement complexe dont la dérégulation est responsable de 75 % des cancers chez l’Homme. Il s’agit notamment d’une protéine qui ne possède pas de structure moléculaire bien définie, ce qui a longtemps entravé le développement de ligands pouvant s’y amarrer et engendrer un effet thérapeutique. À terme, le nouveau composé permettrait de cibler de nombreuses formes de cancer.
La protéine MYC est un facteur de transcription critique dont la dérégulation est impliquée dans la majorité des cancers chez l’Homme. Si en temps normal son activité est strictement contrôlée, elle est surexprimée au niveau des cellules cancéreuses et induit leur prolifération incontrôlée. « MYC ressemble moins à un aliment pour les cellules cancéreuses qu’à un stéroïde qui favorise la croissance rapide du cancer », explique dans un communiqué Min Xue, professeur à l’Université de Californie à Riverside (UCR). « C’est pourquoi MYC est responsable de 75 % de tous les cas de cancer chez l’homme », ajoute-t-il.
Bien que son mécanisme d’action exact fasse encore l’objet de débats, la protéine constitue l’une des cibles pharmacologiques les plus étudiées en oncologie. Cependant, identifier le bon ligand médicamenteux pouvant s’y amarrer représente un véritable défi. En effet, contrairement à la plupart des protéines, MYC ne possède pas de structure bien définie. « C’est essentiellement un monde aléatoire », estime Xue.
Or, le développement de nouveaux médicaments repose principalement sur le ciblage de structures protéiniques bien définies, selon un processus appelé « amarrage protéine-ligand ». Ce dernier consiste à ratisser des millions de structures (voire des milliards) afin de déterminer laquelle se lie de manière suffisamment efficace à sa cible, pour en modifier l’activité et induire un effet thérapeutique.
Cependant, « malgré des décennies de recherche, MYC reste une cible ‘non médicamentable’, sans thérapeutique cliniquement viable », ont écrit Xue et ses collègues dans leur nouvelle étude, parue dans le Journal of Chemical Information and Modeling. Afin de surmonter ces défis, les experts ont exploré une nouvelle technique qui a permis d’identifier un nouveau ligand peptidique pouvant reconnaître MYC avec une fiabilité sans précédent.
Une force de liaison proche de celle d’un anticorps
Bien que la structure désordonnée de MYC a longtemps entravé l’identification de sites d’amarrage de potentiels ligands, différentes molécules ont précédemment été explorées pour leur capacité à se lier à certaines régions de la protéine. Cependant, aucune n’a jusqu’à présent enregistré suffisamment d’affinité pour induire une inhibition significative. D’un autre côté, la protéine exerce sa fonction au niveau du noyau, qui est inaccessible aux molécules de grande taille telles que les anticorps. Les recherches doivent ainsi se concentrer uniquement sur les petites molécules, comme les peptides.
Dans une précédente étude, les experts de l’Université de Californie ont constaté que la modification de la rigidité et de la forme d’un ligand peptidique permettait d’améliorer sa capacité à interagir avec les cibles sans structure définie, comme le MYC. En effet, « les peptides peuvent prendre diverses formes et positions », explique Xue. « Une fois que vous les pliez et les connectez pour former des anneaux [au niveau de la cible], ils ne peuvent pas adopter d’autres formes. Ils ont alors un faible niveau de caractère aléatoire », ajoute-t-il. Cela améliore leur affinité avec la cible.
Sur la base de ces résultats, les chercheurs ont utilisé une technique appelée métathèse d’ouverture et de fermeture de cycle (ROM-RCM) en tandem pour identifier leur ligand. Il s’agit d’un processus complexe de polymérisation, permettant de contrôler la structure et la masse moléculaire du polymère obtenu. L’approche a permis d’identifier NT-B2R, un peptide pouvant se lier directement au MYC avec une affinité dite sub-micromolaire, c’est-à-dire dont la force de liaison se rapproche de celle d’un anticorps.
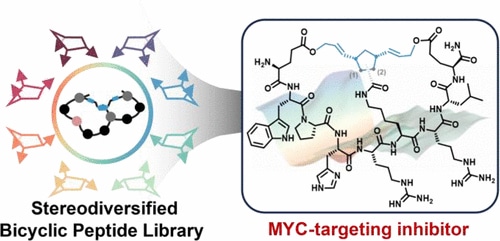


En d’autres termes, il s’agit d’une interaction à la fois très forte et hautement spécifique, supérieure de deux ordres de grandeur par rapport à celle des précédents ligands. Lors d’essais in vitro sur des cellules cancéreuses du cerveau humain, NT-B2R a inhibé avec succès l’activité de MYC, diminuant ainsi le métabolisme des cellules ainsi que leur prolifération.
Toutefois, des améliorations devront encore être obtenues avant les études précliniques et cliniques. Les chercheurs ont notamment utilisé des nanoparticules lipidiques pour livrer le peptide au niveau des cellules, ce qui n’est pas idéal pour une administration médicamenteuse. Néanmoins, la découverte d’un ligand capable d’inhiber efficacement MYC constitue déjà un exploit en soi. « MYC représente essentiellement le chaos, parce qu’il manque de structure. Cela, ainsi que son impact direct sur de nombreux types de cancer, en font l’un des Saint Graal du développement de médicaments contre le cancer », conclut Xue.