Depuis son apparition dans les années 1980, le VIH – virus à l’origine du sida – fait l’objet d’importantes recherches dans l’espoir de trouver un jour un vaccin ou un traitement permettant d’éradiquer définitivement la maladie. Ces années de recherche ont porté leurs fruits : depuis plusieurs années, des traitements antirétroviraux permettent de freiner l’évolution du virus, de vivre normalement – et bien plus longtemps – avec la maladie. En revanche, aucun vaccin efficace n’a vu le jour jusqu’à présent. Des chercheurs américains affirment aujourd’hui être sur la piste d’un nouveau vaccin candidat contre le VIH, testé sur des animaux et offrant une protection efficace et durable.
Selon l’Organisation mondiale de la santé, le virus responsable du sida, le VIH (virus de l’immunodéficience humaine), a causé la mort de plus de 35 millions de personnes depuis son apparition. L’infection se traduit par une détérioration progressive du système immunitaire, qui empêche l’organisme de se défendre contre les infections et les maladies. Aujourd’hui, quelque 38 millions d’individus vivent avec le sida, en majorité dans les pays à revenu faible ou intermédiaire. Chaque année, le VIH continue d’infecter 1,7 million de personnes et d’en tuer près de 770’000. Aujourd’hui encore, c’est donc l’un des principaux problèmes de santé publique dans le monde.
Un virus à fort taux de mutation
Le VIH appartient à la famille des rétrovirus : ce sont des virus à ARN, comportant une enzyme (la transcriptase inverse) qui rétrotranscrit leur génome d’ARN en ADN, afin qu’il s’intègre ensuite dans le génome des cellules hôtes. Malheureusement, cette enzyme commet souvent des erreurs lors de la rétrotranscription, ce qui engendre des formes mutantes du virus. Et cette importante variabilité rend difficile la conception d’un vaccin…
Quelques vaccins sont déjà apparus comme de bons candidats et ont atteint le stade du test clinique. En 2009, premier test encourageant : l’essai RV 144 ou essai « thaï », qui consistait en une combinaison de deux vaccins différents ; l’un était chargé d’amorcer le système immunitaire avec un vecteur viral exprimant trois protéines du VIH (Gag, Pol, Env), l’autre, constitué de protéines Env uniquement, servait de rappel d’immunisation. Résultat : une efficacité d’un peu plus de 30 %. Puis, fin 2016, près de 5400 personnes entament l’essai clinique du vaccin HVTN 702 en Afrique du Sud, basé sur la même stratégie que le RV 144. Mais en février 2020, les autorités sanitaires américaines mettent fin à l’essai, qui s’est avéré peu concluant.
En juillet 2017, une équipe de chercheurs présente le prototype d’un nouveau vaccin, « à double détente », testé chez près de 400 volontaires dans cinq pays ; cette formule a entraîné une réponse immunitaire chez la totalité des participants. Testé deux ans auparavant sur des singes, ce vaccin a permis d’empêcher l’infection chez les deux tiers des animaux ; mais l’incertitude était encore de mise concernant son efficacité à grande échelle sur les humains.
Aujourd’hui, une équipe de chercheurs du Consortium Emory, à Atlanta, présente une nouvelle stratégie de combinaison de vaccins contre le VIH. Testée sur des singes, leur formule a montré une meilleure protection contre l’infection et surtout, plus durable : jusqu’à un an après la vaccination. Leurs résultats viennent d’être publiés dans la revue Nature Medicine.
Une formule « double action »
À l’instar de certaines expérimentations passées, les chercheurs ont misé sur une formule « double action » pour améliorer l’efficacité de leur vaccin. La première action est de stimuler le système immunitaire de manière à ce qu’il fabrique des « anticorps neutralisants », autrement dit, des anticorps capables d’inhiber l’action du VIH. C’est la base de tout vaccin anti-VIH. En parallèle, les chercheurs ont entrepris de booster l’immunité cellulaire : « Nous avons conçu notre vaccin pour générer également une forte réponse immunitaire cellulaire qui se loge dans les tissus muqueux, afin que les deux pans de la réponse immunitaire puissent collaborer pour offrir une meilleure protection », explique Eric Hunter, chercheur au Emory Vaccine Center et l’un des auteurs principaux de l’étude.
L’équipe a donc choisi de stimuler à la fois l’immunité sérique et cellulaire. Les tests ont été réalisés sur trois groupes de quinze macaques, « le meilleur modèle pour tester le potentiel de nouveaux vaccins » selon Hunter. Le premier groupe a reçu plusieurs inoculations séquentielles d’Env, une protéine présente sur la surface externe du virus, connue pour stimuler la production d’anticorps, plus un adjuvant (souvent utilisé dans les vaccins pour améliorer la réponse immunitaire). Le deuxième groupe a reçu les mêmes injections, ainsi que des injections supplémentaires de trois virus atténués différents, modifiés pour contenir le gène d’une protéine virale du VIH, Gag, connue pour stimuler l’immunité cellulaire. Enfin, le troisième groupe témoin a reçu des injections ne contenant qu’un adjuvant.
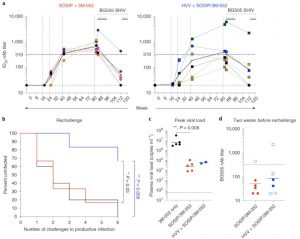
Après 40 semaines de ce traitement, tous les animaux se sont reposés pendant 40 semaines ; les chercheurs leur ont ensuite effectué des rappels d’inoculation d’Env. Après quatre semaines de repos supplémentaires, les chercheurs ont finalement exposé les animaux au SHIV (la version simienne du VIH), dix fois par semaine. Résultats : les singes des deux groupes expérimentaux avaient une protection initiale significative contre l’infection virale (53,3 % de protection pour le 1er groupe, près de 67 % pour le second), liée à des concentrations d’anticorps neutralisants élevées, les plus élevées ayant été observées dans le premier groupe qui n’a reçu que des inoculations de protéine Env.

Encore plus remarquable, ajoutent les chercheurs, est le fait que plusieurs singes du groupe Env+Gag – mais aucun du groupe Env – demeuraient non infectés 5 mois plus tard, alors que leur taux d’anticorps neutralisants n’était pas particulièrement élevé. Cette observation a surpris l’équipe de recherche : « C’est un résultat intrigant, car l’augmentation de la puissance des anticorps neutralisants était considérée comme cruciale pour l’efficacité d’un vaccin », ajoute Cynthia Derdeyn, une collègue de Hunter. Or, maintenir un taux élevé de ces anticorps sur la durée est très difficile à réaliser.
Une meilleure protection, qui nécessite moins d’anticorps
Allonger la durée de protection d’un vaccin contre le VIH demeure l’un des principaux défis à relever pour les scientifiques. Mais Rama Amara, professeur en immunologie et microbiologie à Emory et co-auteur, estime que cette nouvelle étude est plutôt encourageante sur ce point : « Lorsque nous avons renouvelé l’inoculation d’Env un an après avoir administré les vaccins, les animaux ayant initialement reçu la combinaison Env+Gag ont affiché une augmentation prononcée de la durée de protection ». Ce n’est pas le cas du groupe ayant reçu la vaccination Env-only, qui affichait pourtant un taux plus élevé d’anticorps neutralisants. Ainsi, les chercheurs suggèrent que les réponses immunitaires cellulaires réduisent le seuil d’anticorps neutralisants requis pour conférer une protection supérieure et durable.
Sur le même sujet : Des virologues découvrent une nouvelle souche du VIH
L’équipe utilisera ces résultats pour affiner son approche du développement de vaccins. Au vu des résultats obtenus avec le groupe Env+Gag, ils envisagent d’étudier plus avant les stratégies basées sur une stimulation simultanée de la fabrication d’anticorps neutralisants et de la réponse cellulaire. Ils espèrent ainsi faire passer cette nouvelle approche dans les essais cliniques, sachant que cette stratégie pourrait avoir un impact bien plus large : « Nous pensons que la même approche pourrait être envisageable pour d’autres agents pathogènes, notamment la grippe, la tuberculose, le paludisme et, maintenant, COVID-19 », précise Amara.