Des chercheurs ont développé des cellules artificielles pouvant exprimer des protéines comme les cellules naturelles. Développées par le biais d’un processus appelé auto-assemblage induit par polymérisation biocatalytique (bioPISA), les nouvelles structures peuvent servir de microréacteurs pour les réactions enzymatiques et la biominéralisation. À terme, ces cellules pourraient avoir d’importantes implications en médecine et même éclairer les mystères de l’origine de la vie sur Terre.
Malgré les importantes avancées ces dernières décennies, la synthèse de cellules entièrement artificielles présente de nombreux défis. En effet, même les organismes unicellulaires les plus simples sont régis par des processus biomoléculaires extrêmement complexes. Les dernières avancées réalisées dans le domaine impliquent par exemple des compartiments artificiels, qui ont permis d’étudier la transcription et la traduction acellulaire. Parmi ces structures, les compartiments biomimétiques en polymère ont particulièrement suscité l’intérêt des scientifiques, en raison de leur grande stabilité par rapport aux autres assemblages. D’autre part, la polyvalence chimique des polymères permet de concevoir des structures dotées de multiples fonctions moléculaires, telles que la biodégradabilité, la perméabilité et la réactivité aux stimuli.
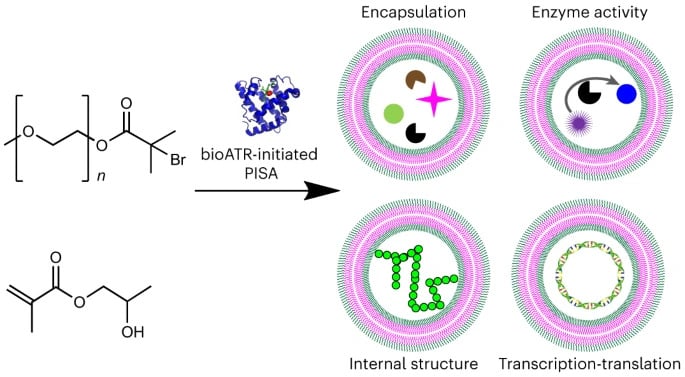
Cependant, la plupart des approches de production de cellules artificielles basées sur les polymères présentent des obstacles significatifs, entravant l’efficacité de l’encapsulation de la cargaison fonctionnelle. La technique d’autoassemblage induit par polymérisation (PISA) a été développée dans le but de surmonter ces limitations. Elle consiste à synthétiser des copolymères en blocs amphiphiles (possédant une partie hydrophile et lipophile) dans des solutions aqueuses, en polymérisant un monomère soluble dans l’eau en un bloc insoluble. Plus précisément, au cours de la phase initiale de polymérisation, le copolymère est encore soluble dans l’eau. Ensuite, une fois que le bloc hydrophobe atteint une certaine longueur, les copolymères commencent à s’autoassembler de sorte à réduire le rapport hydrophile/hydrophobe. La morphologie des structures assemblées évolue en micelles puis en vésicules, ce qui permet de réaliser efficacement les encapsulations.
Toutefois, malgré sa biocompatibilité, la technique PISA comporte encore des limites concernant l’incorporation de molécules biologiques dans les compartiments en polymère. En effet, ses conditions d’initiation peuvent potentiellement nuire à l’intégrité des molécules les plus sensibles. Des experts de l’Université de Darmstadt et de Strathclyde, pensent que la technique bioPISA, développée dans le cadre de leur nouvelle étude (publiée dans Nature Chemistry), pourrait permettre de combler ces lacunes. Le groupe de recherche incluait également des chercheurs de l’Université de Fribourg et de Bâle ainsi que de l’Institut Adolphe Merkle, en Suisse.
En effet, BioPISA permettrait entre autres de coupler la synthèse et l’auto-assemblage de polymères par le biais de PISA avec des processus biologiques ou biomimétiques. « Notre étude comble une lacune cruciale dans la biologie synthétique, en fusionnant le monde des matériaux synthétiques avec des processus enzymatiques pour créer des cellules artificielles complexes, tout comme de vraies cellules », explique dans un communiqué l’auteur principal de l’étude, Andrea Belluati, de l’Université de Strathclyde (Écosse). « Cela ouvre de nouveaux horizons dans la création de cellules imitatrices qui ne sont pas seulement structurellement similaires aux cellules biologiques, mais également fonctionnellement compétentes », ajoute-t-il.
Des cellules artificielles agissant comme des microréacteurs
La technique bioPISA est basée sur la polymérisation radicalaire par transfert d’atome (ATRP) à médiation enzymatique. Les catalyseurs bioATRP comprennent des enzymes hèmes (un cofacteur contenant un atome métallique) telles que la peroxydase de raifort, l’hémoglobine, la catalase et les laccases contenant du cuivre.
« Les polymérisations radicalaires enzymatiques sont la clé de la création de ces cellules artificielles. Les enzymes synthétisent des polymères qui s’auto-assemblent pendant que la polymérisation encapsule les polymères de taille nano et micro », explique le coauteur de l’étude, Nicolas Bruns, de l’Université de Strathclyde et de Darmstadt. « Il s’agit d’un moyen très simple mais efficace de préparer les cellules artificielles », déclare-t-il.
Pour synthétiser les cellules artificielles, la nouvelle méthode s’appuie la myoglobine afin d’induire la synthèse des blocs de copolymères amphiphiles, s’autoassemblant en micelles et en vésicules unilamellaires géantes (GUV). La myoglobine a été sélectionnée en tant que biocatalyseur car il s’agit d’une petite protéine stable pouvant fonctionner à un pH relativement neutre. En revanche, l’hémoglobine nécessite un pH acide pour pouvoir acquérir des propriétés similaires, ce qui n’est pas nécessairement biologiquement pertinent.
Au cours de la polymérisation, les GUV obtenus ont pu encapsuler avec succès des cargaisons de contenu soluble (c’est-à-dire le cytosol) de cellules bactériennes, comprenant notamment des enzymes, des nanoparticules, des microparticules, des plasmides et du lysat cellulaire. Les cellules artificielles résultantes ont agi comme des microréacteurs pour les réactions enzymatiques et pour la biominéralisation (à l’instar des ostéoblastes).
En outre, elles ont pu exprimer des protéines fluorescentes et de l’actine lorsqu’elles ont été alimentées avec des acides aminés. Par ailleurs, en se polymérisant à l’intérieur des cellules, l’actine a modifié leur structure en créant des sous-compartiments internes, formant des échafaudages ressemblant à un cytosquelette. Cela suggère que ces cellules pourraient imiter les bactéries naturelles, car elles sont composées d’un compartiment de réaction microscopique — contenant des informations pour l’expression des protéines.
Ces résultats suggèrent non seulement que l’expression de protéines imite celles régissant les propriétés fondamentales des cellules vivantes, mais mettent également en lumière le potentiel de ces cellules artificielles dans diverses applications, allant de l’administration de médicaments à l’ingénierie tissulaire, sans compter la compréhension de l’apparition de la vie. Prochainement, les chercheurs prévoient d’explorer l’expression de ces protéines pour catalyser d’autres polymérisations, dans le but d’imiter la croissance et la réplication des cellules naturelles.