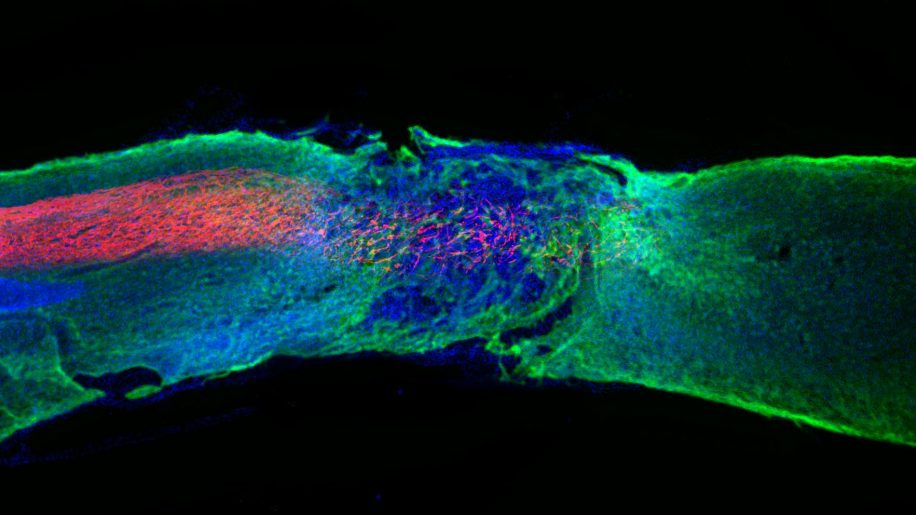
La moelle épinière serpente du cerveau à notre colonne vertébrale. Point de départ de nombreux nerfs, elle joue le rôle de relai entre cerveau et membres. Sans elle, pas de mouvements volontaires. Problème : lorsqu’une lésion l’endommage, la moelle épinière ne se régénère pas. C’est ce qui cause la paraplégie, ou paralysie des membres inférieurs. Cette maladie semblait incurable… jusqu’à hier ! Une équipe de chercheurs américains vient de développer un traitement qui rétablit partiellement des souris paralytiques en 3 semaines. Leur secret ? Des nanofibres de molécules thérapeutiques qui induisent la régénération de la moelle épinière.
C’est une publication qui fera date ! Des chercheurs américains de la Northwestern University ont testé un traitement expérimental prometteur contre la paraplégie sur des souris paralysées des membres inférieurs. Les résultats de leur recherche sortent aujourd’hui dans la prestigieuse revue Science. Chose inédite, la thérapie expérimentale choisie l’a été suivant la capacité de ses molécules constitutives à former une nanofibre dynamique.
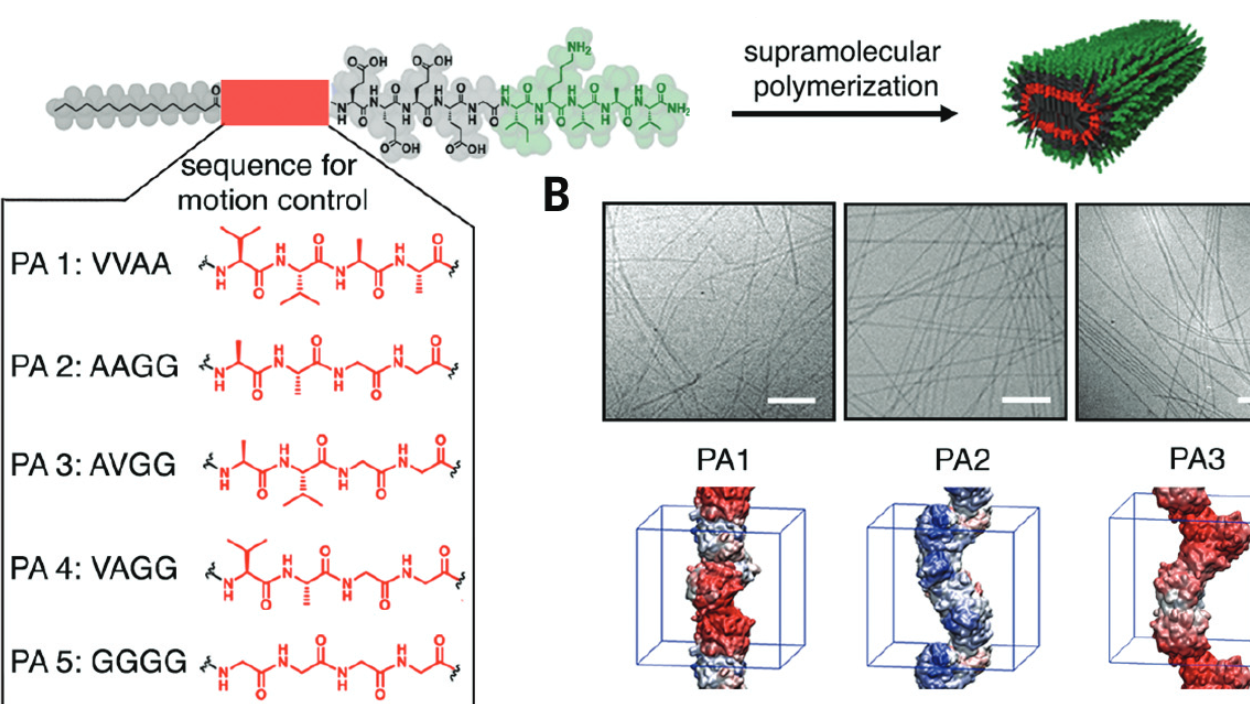
Nanofibre dynamique, késako ? Pour comprendre, revenons au commencement. Ce qu’injectent les scientifiques aux souris paralysées est en fait un savant mélange de Peptides Amphiphiles (PA), des dérivés de protéines qui ont une longue queue hydrophobe (repoussée par l’eau) d’un côté et une extrémité hydrophile (attirée par l’eau) de l’autre. Résultat : dès qu’ils arrivent dans la moelle épinière endommagée, les PA se regroupent instantanément en nanofibres, leurs queues hydrophobes protégées de l’eau au cœur de la structure cylindrique. Les extrémités hydrophiles des PA entrent alors en contact avec la surface des cellules… et c’est grâce à elles que la magie opère.
Régénérer les neurones et leur environnement
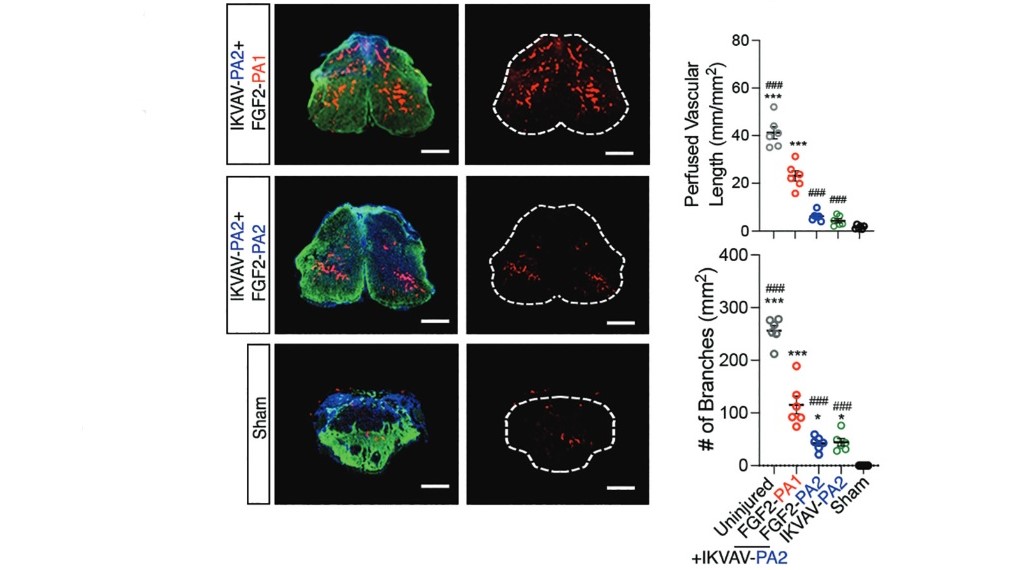
Pour être plus précis, l’injection regroupe deux PA. Le premier a une extrémité hydrophile dérivée d’une séquence de cinq acides aminés (les briques élémentaires des protéines) qui permet, une fois repérée par un récepteur cellulaire, la croissance des axones — les prolongements des neurones conduisant l’influx nerveux — et la différenciation des neurones. En clair, lorsqu’elle entre en contact avec les cellules de la moelle épinière endommagée, cette extrémité hydrophile « répare les circuits ». Mais, contrairement à une installation électrique, les circuits nerveux sont des cellules vivantes qui ont besoin de nutriments pour vivre, et donc de cellules de soutien et de capillaires sanguins.
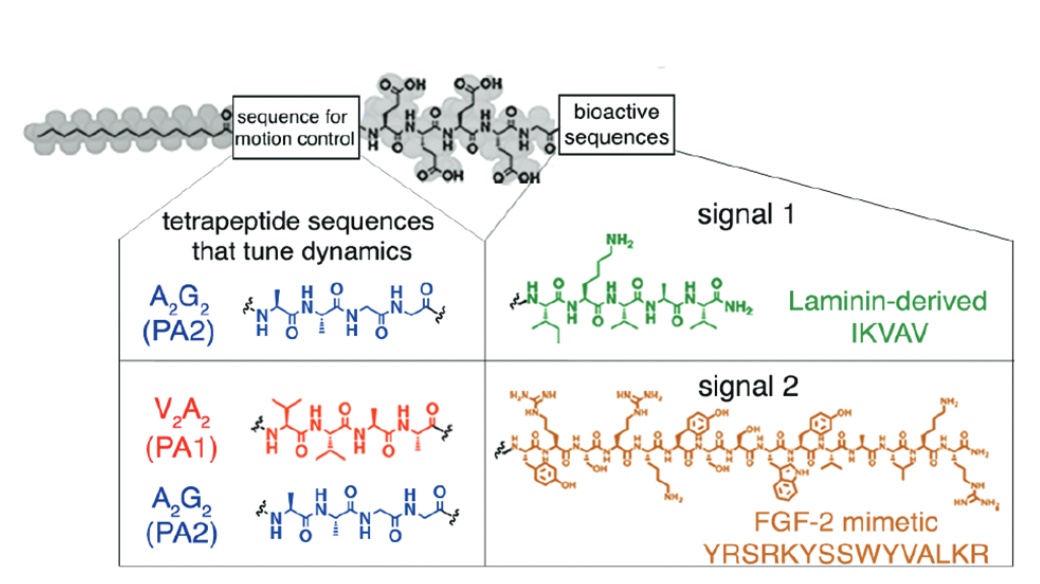
C’est là qu’intervient le deuxième PA : son extrémité hydrophile contient une séquence d’acides aminés qui mime un facteur de croissance. Une fois repérée par un récepteur cellulaire, cette dernière active la régénérescence des autres cellules de la moelle épinière. Alors que l’utilisation de polymères de PA avait déjà été testée auparavant avec un succès d’estime pour guérir des souris de la paralysie, la nouveauté introduite par l’équipe américaine a été de sélectionner les PA les plus efficaces… en les sélectionnant sur leur mobilité dans les nanofibres !
En effet, deux séquences moléculaires différencient les PA des nanofibres : l’extrémité hydrophile et une séquence variable, de quatre acides aminés seulement, qui modifie leur mobilité. Les chercheurs ont donc choisi les séquences variables permettant le plus de mouvements des PA à l’intérieur de la nanofibre, parmi huit possibilités. « Dans les cellules, les récepteurs bougent constamment. Notre innovation clé, c’est de contrôler le mouvement des PA dans nos nanofibres pour les connecter plus efficacement aux récepteurs cellulaires », explique pour Northwestern Now Samuel I. Stupp, le chef du projet.
Une impressionnante progression
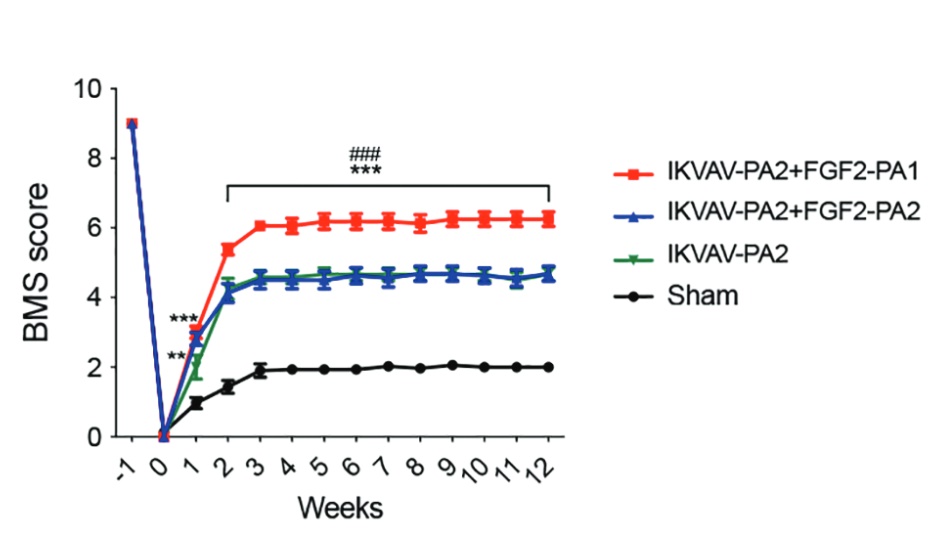
À l’issue de cette sélection des meilleures séquences variables, le succès est au rendez-vous. Dans les progrès des souris paralytiques, dans leurs coupes de moelle épinière, ou encore dans les cultures in vitro de cellules souches neuronales humaines, les progrès sont éclatants. Trois semaines auront suffi aux 38 souris paraplégiques traitées avec les meilleures séquences variables de PA pour recouvrer l’usage partiel de leurs membres inférieurs et redévelopper un début de moelle épinière fonctionnelle au niveau de leur lésion.
Cette réussite pousse Samuel I. Stupp à rêver encore plus grand : l’amélioration de l’agitation moléculaire de peptides amphiphiles thérapeutiques pourrait bien servir à guérir d’autres maladies… « Le tissu nerveux endommagé que nous avons réparé est similaire à celui qu’on trouve dans le cerveau de personnes atteintes d’AVC ou de maladies neurodégénératives, comme la maladie d’Alzheimer ou de Parkinson », conclut le chercheur.