Les hydrogels injectables sont utilisés en médecine dans nombre de cas, que ce soit pour la reconstruction chirurgicale, la réparation musculaire ou du cartilage. Une équipe du département de Chimie de l’Université de Caroline du Nord, dirigée par Foad Vashahi, a mis au point un hydrogel doté d’une structure unique mimant les propriétés physiques des tissus mous (même ceux du cerveau) et résistant à la déformation.
Par définition, un hydrogel injectable est une solution aqueuse composée de polymères qui se gélifient une fois dans le tissu ciblé, par exemple le muscle. On peut y adjoindre des médicaments comme des anti-inflammatoires ou des traitements pour chimiothérapie. Mais avec le temps, certains composants résiduels peuvent, par lixiviation, voyager à travers le corps.
Dissonance entre hydrogels actuels et nos tissus
En d’autres termes, l’eau contenue dans le gel percole à travers les tissus, entrainant les monomères du gel (le polymère s’étant dégradé en composés plus simples, les monomères) à travers le corps, sans que nous puissions contrôler ce phénomène. Ces molécules sont potentiellement nocives pour le corps. La perte d’eau entraîne également un rétrécissement de l’implant, ce qui risque de poser problème en chirurgie reconstructive si les cavités ne sont plus comblées.
Enfin, les gels actuels ne semblent pas pouvoir suivre la courbe de déformation des tissus mous. Cette courbe liant la contrainte exercée sur le tissu et la déformation que celui-ci subit, forme un J, avec une déformation douce au départ suivie d’une déformation plus brutale, jusqu’à la raideur (voir figure ci-dessous).
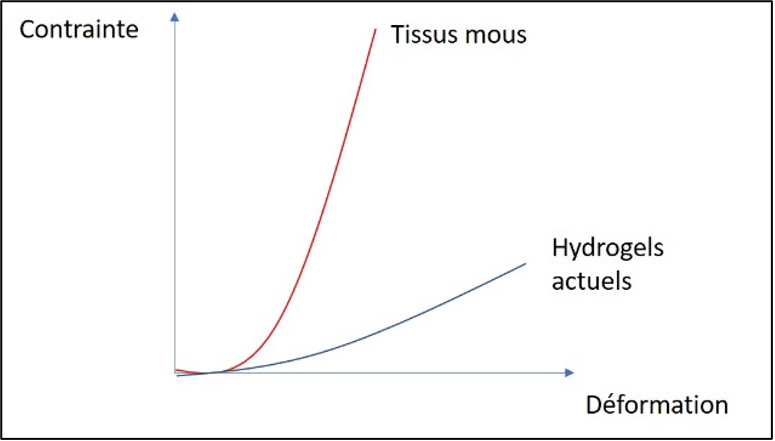
Les tissus mous comprennent les vaisseaux sanguins, les muscles, la peau, … On visualise facilement les contraintes qui sont exercées sur notre peau, mais les vaisseaux sanguins doivent en plus résister à la pression induite par le passage du sang. On comprend aisément que si l’on injecte un hydrogel, par exemple dans l’un de ces tissus mous, et qu’il rétrécit ou ne peut suivre la courbe de déformation du tissu, son potentiel thérapeutique est réduit à néant.
Un nouveau design pour les polymères de l’hydrogel
Les polymères actuels des hydrogels sont linéaires, c’est-à-dire qu’ils sont formés d’une chaîne continue linéaire. Ici, l’innovation réside dans la structure de ces polymères en forme de brosse ou de goupillon, liés à des parties linéaires latérales. Cette architecture permet d’augmenter la viscosité naturelle du gel, car les polymères en brosse sont moins enchevêtrés entre eux, et le produit est ainsi plus fluide. Nous pouvons utiliser l’analogie des cheveux brossés, plus souples que des cheveux emmêlés formant une masse compacte. De manière consécutive, l’apport en eau pour obtenir la bonne texture du gel est considérablement réduit, le gel étant déjà fluide.
La distinction entre les blocs linéaires des extrémités et les brosses centrales rend le gel résistant à une déformation de 700%, et lui permet d’augmenter son volume lors de la gélification dans le tissu, sans perte d’eau. Le problème de lixiviation, cité plus haut, est donc résolu.
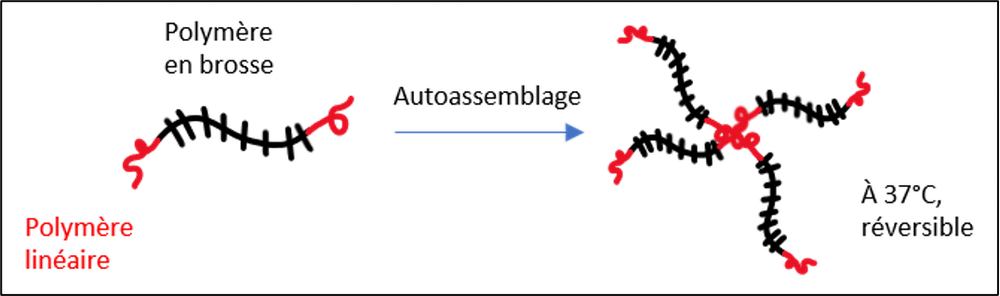
La gélification, c’est-à-dire l’autoassemblage des différents polymères entre eux, se fait à une température précise variant avec la taille des polymères. Plus ils sont grands, moins la température de gélification est élevée. Les structures en brosse/linéaires s’autoassemblent donc à des températures précises, et les chercheurs soulignent que ces structures peuvent se réassocier rapidement en cas de rupture ! La structure est rendue permanente par l’ajout de molécules réagissant aux UVS.
L’utilisation de ces deux formes (brosse et linéaire) permet de moduler le comportement final de l’hydrogel dans le corps, en le rendant plus ou moins raide selon le tissu visé. Un hydrogel à la structure finale plus molle est nécessaire pour un tissu comme le cerveau ou le muscle, et à l’inverse, une structure finale plus raide pour les intestins ou les poumons.
Les auteurs concluent que « comme le confirment les expériences in vitro et in vivo, les hydrogels injectables peuvent être utilisés soit comme charges corporelles pour la chirurgie reconstructive, soit comme bio-encres lorsqu’ils sont mélangés à des cellules pour l’ingénierie tissulaire. Ces matériaux sont facilement adaptables pour la fabrication additive d’objets à forme spécifique, tels que des organes ».
C’est donc une petite révolution dans le domaine des hydrogels. Cette avancée nécessite encore quelques travaux de recherche pour confirmer les résultats des expériences et permettre l’utilisation à large échelle de l’hydrogel mimant les tissus mous, par exemple pour combler les lésions du cerveau à la suite d’un accident vasculaire.