Des chercheurs ont découvert que des protéines de tardigrade, lorsqu’elles sont exprimées au niveau de cellules humaines, peuvent ralentir leur métabolisme et améliorer leur survie. Le processus, réversible, induit la production d’un gel à l’intérieur des cellules et enclenche la biostase. Ces protéines pourraient ouvrir la voie à de nouvelles stratégies antivieillissement et aider à améliorer les méthodes de conservation cellulaire.
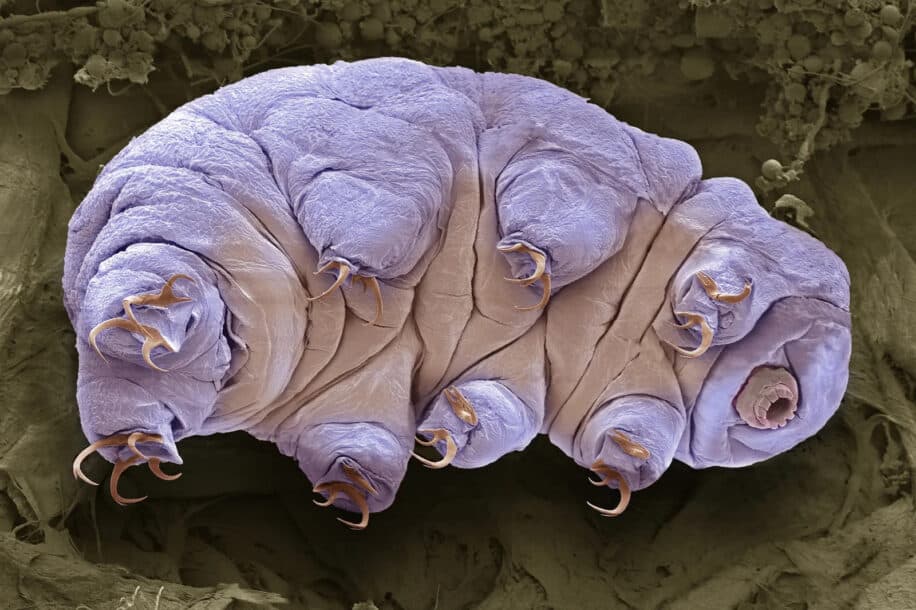
Les tardigrades (ou oursons d’eau) sont parmi les organismes les plus résilients sur Terre. Mesurant en moyenne moins d’un demi-millimètre de long, ils sont notamment dotés d’une incroyable capacité à survivre dans des conditions extrêmes. Ils peuvent par exemple résister à des températures allant de quelques degrés au-dessus du zéro absolu à 150 °C ainsi qu’à des niveaux de radiation que presque aucun organisme vivant ne pourrait supporter, sans oublier leur incroyable résilience face au vide de l’espace.
À l’instar des tardigrades, un certain nombre d’autres organismes sont également tolérants à la dessiccation. Dans un environnement dépourvu d’eau, ces derniers entrent dans un état de biostase (arrêt temporaire des fonctions vitales) appelé anhydrobiose. Dans cet état, ils suspendent totalement leur métabolisme jusqu’à leur réhydratation. Les organismes anhydrobiotiques protègent leurs cellules des dommages induits par le dessèchement en accumulant des sucres non réducteurs, tels que le saccharose.
En revanche, la manière dont les tardigrades survivent à la dessiccation est particulièrement intrigante. En effet, ils n’accumulent que très peu de sucre, voire pas du tout. Au lieu de cela, ils s’appuient sur un large éventail de protéines désordonnées qui leur fournissent une protection adaptative à la déshydratation. Parmi ces protéines figurent celles dites « cytoplasmiques abondantes thermosolubles » (CAHS).
Cependant, la façon dont ces protéines enclenchent la biostase chez les tardigrades est en grande partie incomprise. Dans leur nouvelle étude publiée dans la revue Protein Science, des chercheurs de l’Université du Wyoming (aux États-Unis) ont exploré plus avant les processus induits par ces protéines en examinant leurs effets sur des cellules humaines. « Nos résultats ouvrent la voie au développement de technologies centrées sur l’induction de la biostase dans les cellules et même dans des organismes entiers pour ralentir le vieillissement et améliorer le stockage et la stabilité », ont-ils expliqué dans un communiqué.
Un gel induisant une biostase réversible
Dans le cadre de la nouvelle étude, les chercheurs se sont concentrés sur la CAHS D, une protéine CAHS utilisée par le tardigrade Hypsibius exemplaris pour l’anhydrobiose. D’autres recherches ont précédemment montré qu’en étant exprimée chez des levures et des bactéries, cette protéine a un effet protecteur contre les dommages induits par la dessiccation.
Au cours du processus menant à l’anhydrobiose, CAHS D passe d’un état de solution à celui de gel solide. Il a été suggéré que cette gélification pourrait jouer un rôle dans la capacité protectrice des protéines CAHS. Cependant, les mécanismes moléculaires sous-tendant cette gélification n’ont pas été entièrement explorés. En effet, le lien entre la gélification de CAHS et sa capacité de protection est largement spéculatif, et aucune étude empirique n’a jusqu’à présent été menée dans ce sens.
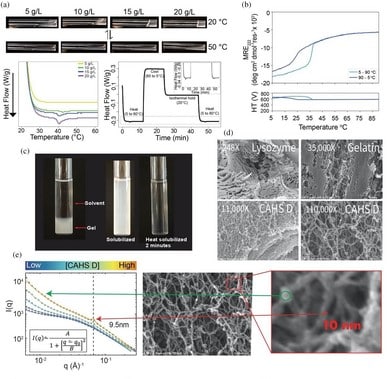
Afin d’explorer la question, les experts de l’Université du Wyoming ont analysé la structure des hydrogels CAHS D à l’aide de la microscopie électronique à balayage (MEB) et la diffusion de rayons X aux petits angles (SAXS) — une technique analytique qui mesure l’intensité des rayons X diffusés par un échantillon en fonction de l’angle de diffusion. Afin d’analyser les interactions moléculaires menant à la gélification, les chercheurs ont combiné des approches informatique et biophysique.
Ils ont constaté que les hydrogels CAHS D sont composés d’un réseau entremêlé de fibres d’environ 10 nanomètres de long. La transition vers l’état de gel est induite par des changements de concentration du milieu liquide et de la température. Cela enclenche un stress osmotique, après quoi la protéine s’accumule en amas fibreux de plus en plus denses jusqu’à former un assemblage de type cytosquelette. La gélification de la protéine restreint les mouvements moléculaires, ainsi que ceux des matériaux biologiques sensibles à la déshydratation.
Lors d’essais sur des cellules humaines, il a constaté que la fibrillation de CAHS D induit une protection contre le stress osmotique, en induisant une résistance au changement de volume et en ralentissant le métabolisme. « Étonnamment, lorsque nous introduisons ces protéines dans les cellules humaines, elles se gélifient et ralentissent le métabolisme, tout comme chez les tardigrades », explique Silvia Sanchez-Martinez de l’Université du Wyoming, auteure principale de la recherche. « De plus, tout comme les tardigrades, les cellules humaines qui contiennent ces protéines en biostase deviennent plus résistantes au stress, conférant certaines des capacités des tardigrades », ajoute-t-elle.
Le ralentissement métabolique induit par la gélification de CAHS D était fortement corrélé à une amélioration de la survie des cellules. En outre, la condensation de la protéine ainsi que les effets induits sont réversibles avec le retour à des conditions osmotiques normales. « Lorsque le stress est soulagé, les gels tardigrades se dissolvent et les cellules humaines reprennent leur métabolisme normal », indique Thomas Boothby, l’un des auteurs de l’étude et chercheur à l’Université du Wyoming.
Ces résultats promettent de larges perspectives d’application pour les protéines des tardigrades, telles que les stratégies de ralentissement du vieillissement et le stockage des cellules souches pour les thérapies cellulaires. Une précédente recherche, menée par la même équipe, a d’ailleurs montré que des versions naturelles et artificielles de protéines de tardigrade peuvent être utilisées pour stabiliser un composé essentiel pour le traitement de l’hémophilie, sans nécessiter de réfrigération.